HISAKOの美容通信2025年10月号
EDのリスクファクター~老化や病気(糖尿病,癌等),手術/外傷,ストレス,肥満等で、体(代謝)はどう変わっているのか?
 EDのリスクファクターは数多くありますが、主なものとしては、12因子、つまり、①加齢、②糖尿病、③肥満/運動不足、④心血管疾患/高血圧、⑤喫煙、⑥テストステロン低下、⑦慢性腎臓病/下部尿路症状、⑧神経疾患、⑨手術/外傷、⑩鬱等の精神的因子、⑪薬物、⑫睡眠時無呼吸症候群が挙げられます。中でも、老化や病気(糖尿病や癌等)、手術/外傷、ストレス、肥満等で、体の中で何が起こっているのか(代謝)を解説します。
EDのリスクファクターは数多くありますが、主なものとしては、12因子、つまり、①加齢、②糖尿病、③肥満/運動不足、④心血管疾患/高血圧、⑤喫煙、⑥テストステロン低下、⑦慢性腎臓病/下部尿路症状、⑧神経疾患、⑨手術/外傷、⑩鬱等の精神的因子、⑪薬物、⑫睡眠時無呼吸症候群が挙げられます。中でも、老化や病気(糖尿病や癌等)、手術/外傷、ストレス、肥満等で、体の中で何が起こっているのか(代謝)を解説します。
EDとは、満足な性行為を行うのに十分な勃起が得られないか、又は持続出来ない状態が持続又は継続する事で、他覚的なものではなく、本人の自覚により決まります。ですから、本人が満足していれば、それって半立ちじゃない?って医者が思おうと、EDではありません。反対に、太く猛々しく聳え、びくんびくんと脈打っているじゃん!と医者が思っても、本人が思っていなければ、それは十分にEDです。
今月号では、EDのリスクファクターである老化や糖尿病、肥満等の際に、体の中で代謝がどのように変化しているかを解説します。
老化や手術、病気、摂食障害による低栄養
男性更年期再考(美容通信2025年6月号)でも触れましたが、高齢化社会の現代では、低栄養は大きな課題の一つとされています。
低栄養状態について
体内に蓄えられているエネルギー源は、圧倒的に脂肪が多く、この量の大小で絶食して生き延びられる期間が決まります。次いで多いのがグリコーゲンですが、脂肪に比して貯蔵量は少なく、直ぐに消費されてしまいます。最後が蛋白質ですが、本来は生体機能を担う物質なので、その分解は最小限です。また、最終段階で消費されると誤解を受けやすいですが、実際は早期から分解されます。
■絶食時のグルコースの代謝
エネルギー供給源としては、貯蔵量と1日の供給量のどちらを取っても、グルコースよりも脂肪の方が貢献度が大ですが、脂肪では決して肩代わりが出来ない重要な役割をグルコースは担っています。例えば、脳みそや赤血球にはグルコースが必須で、常に一定のレベルが供給される必要があります。
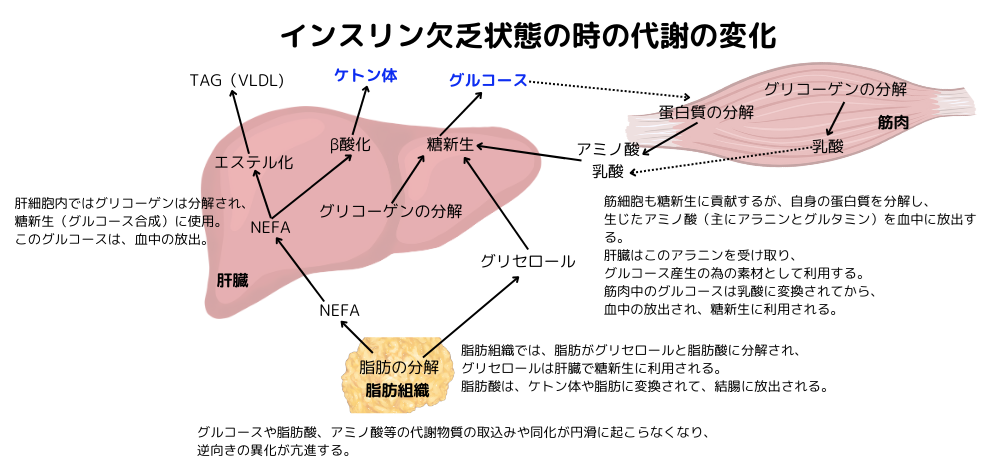
 左図は、絶食時のグルコース、脂肪酸、ケトン体の合成について、臓器相関と言う観点から纏めた図です。肝臓に貯蔵されたグリコーゲンが分解されて、グルコースが供給されるところから先ずはスタートします。貯蔵グリコーゲンはすぐに枯渇してしまうので、その次は肝臓の糖新生にバトンタッチし、グルコースを他の組織に供給するようになります。重要な供給先としては脳みそで、1日に100~120gのグルコースを要します。この糖新生に利用される主な基質は、筋肉の蛋白質分解により生じるアラニンとグルタミンです。その為、絶食時には筋蛋白質が1日に約150g分解されてしまいます。その結果、筋肉は痩せ、その機能は驚く程低下します。例えば、手術後の絶食期間にも筋肉の痩せは必発です。
左図は、絶食時のグルコース、脂肪酸、ケトン体の合成について、臓器相関と言う観点から纏めた図です。肝臓に貯蔵されたグリコーゲンが分解されて、グルコースが供給されるところから先ずはスタートします。貯蔵グリコーゲンはすぐに枯渇してしまうので、その次は肝臓の糖新生にバトンタッチし、グルコースを他の組織に供給するようになります。重要な供給先としては脳みそで、1日に100~120gのグルコースを要します。この糖新生に利用される主な基質は、筋肉の蛋白質分解により生じるアラニンとグルタミンです。その為、絶食時には筋蛋白質が1日に約150g分解されてしまいます。その結果、筋肉は痩せ、その機能は驚く程低下します。例えば、手術後の絶食期間にも筋肉の痩せは必発です。
糖新生に利用されるもう一つの基質は、赤血球や腎臓から供給される乳酸です。その由来はピルビン酸で、元を辿ればグルコース。赤血球にはミトコンドリアがそもそもないし、腎臓の髄質は酸素が殆ど利用出来ない環境下にあり、ミトコンドリアが働けないと言う特殊な事情がある為、赤血球や腎臓の髄質は、ケトン体を殆ど利用出来ません。それ故、妥協案とは言いませんが、嫌気的解糖系でグルコースを消費し、乳酸を放出します。乳酸は、糖新生の素材にもなるし、色々な組織でそのまま利用可能(ピルビン酸に変換され、クエン酸経路に入る!)と、使い勝手が非常に良いエネルギー源となる基質です。
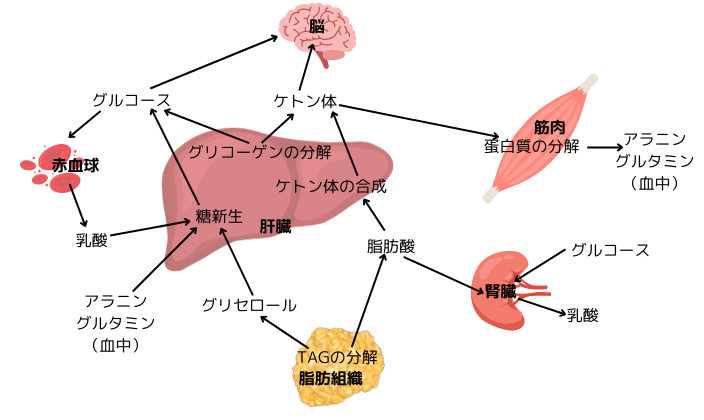
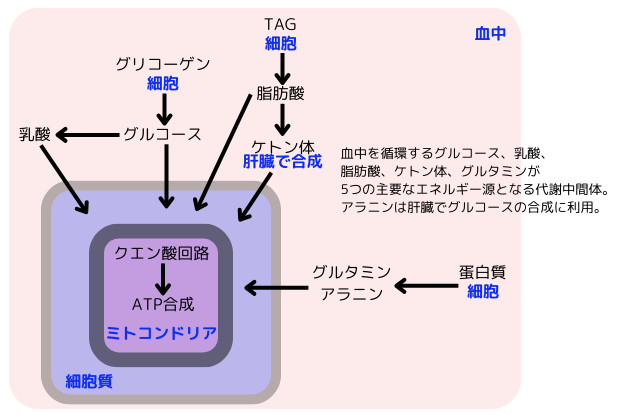 右図の如く、血中を循環する代謝回転の速いグルコース、乳酸、脂肪酸、ケトン体は、全てアセチルCoAまで分解され、クエン酸回路に入ります。蛋白質分解により生じるアラニンやグルタミンもエネルギー源となり、アラニンは肝臓でグルコースに変換されて、直接クエン酸回路に入ります。これらの5種類の物質は、血液中を循環して様々な組織に取り込まれ、エネルギー源として利用されます。
右図の如く、血中を循環する代謝回転の速いグルコース、乳酸、脂肪酸、ケトン体は、全てアセチルCoAまで分解され、クエン酸回路に入ります。蛋白質分解により生じるアラニンやグルタミンもエネルギー源となり、アラニンは肝臓でグルコースに変換されて、直接クエン酸回路に入ります。これらの5種類の物質は、血液中を循環して様々な組織に取り込まれ、エネルギー源として利用されます。
■絶食時の脂肪の代謝:主要なエネルギー源は脂肪である
飢餓状態の時の主なエネルギー源は、何と言っても脂肪組織から供給されるTAGです。絶食開始後、脂肪の分解が始まり、生じる脂肪酸の血中濃度が上昇します。左上図の如く、脂肪酸からのグルコース合成はありませんが、グルコースの無駄使いを抑制するだけでなく、代用品であるケトン体が産生され、脳みそを始めとする多くの臓器で利用されるようになります。絶食3週目になると、ケトン体の血中濃度は6~7nmol/l(平時は0.2nmol/l以下)にまで上昇し、脳みぞが必要とするエネルギー量の2/3を補うようになります。
■飢餓に適応する時期の代謝~グルコース消費が抑制される
絶食開始後3週目以降は、飢餓への適応が完了した時期と考えられ、これは高齢者に多く認められがちな低栄養状態が長く続いた場合と同様の代謝環境です。出来るだけエネルギー源には脂肪を使い、グルコースを温存すると言う代謝応答が起こっています。
グルコースがピルビン酸経由でアセチルCoAにまで酸化はされても、逆方向への反応はあり得ません。ピルビン酸をアセチルCoAに変換する酵素であるピルビン酸デヒドロゲナーゼ(PDH)は一方通行で、逆走の手助けはしないからです。絶食時には、PDHキナーゼが調節因子として働き、PDHの活性を低く保つ事で、グルコースの消費を抑制しています。
ご飯を再び食べる様になれば、この様な苦渋に満ちた選択をとっとと終わりにしますが、叶わない場合は、呼吸筋が弱り、肺を十分に清潔に保てなくなり、肺炎を発症し、多くは死に至ります。癌等の重篤な病気の末期になると摂食障害が顕著になりますが、同じ様な病態が起こっています。低栄養状態に陥った時、どこまで生き延びれるかは、脂肪の貯蔵量次第です。健康な人ならば、幽閉されて食事を与えられなくても、約2か月間は生き延びれると言われていますが…。
■様々なホルモンによる飢餓への対応
飢餓に対する生体応答には、上図の如くに、ホルモンの作用が大きく関わっています。
絶食開始後は、グルコース濃度が徐々に低下し、これを感知したインスリンは、分泌を大幅に減らします。これにより、グルコースの浪費を少しでも抑制しようとます。一方、グルカゴンの分泌は小幅ながら上昇し、インスリン/グルカゴン比は低下します。
インスリン分泌の低下に続いて、脂肪組織から分泌されるレプチンの分泌も低下します。逆に、FGF21(線維芽細胞増殖因子21:fibroblast growth factor21)の分泌は上昇し、肝臓での糖新生とケトン体合成を促進します。同時に、脂肪組織からの脂肪酸の放出も促進されます。
絶食時には、甲状腺ホルモンT3の分泌の低下が認められます。T3の受容体はどの細胞にも存在しますが、T3には細胞の代謝経路を活性化させる働きがある(美容通信2015年3月号)ので、これを抑制する事で、グルコースや脂肪酸の代謝を抑制します。T3の分泌低下を引き起こす要因は幾つかありますが、その一つとしてはレプチンの分泌低下によるもので、脳の視床下部にシグナルが伝達され、脳下垂体からの指令で甲状腺からT3分泌を抑制させます。脂肪組織に脂肪が多く貯蔵されると、それがシグナルとなってレプチンが分泌され、血液中を流れて視床下部のレプチン受容体に結合し、エネルギーの摂取の抑制とエネルギー消費の亢進のシグナルを伝達させます。反対に、レプチンの分泌が低下すると、エネルギーの消費の抑制が起こりますが、その実行手段の一つにT3の分泌抑制があると言う事です。
交感神経系や副腎髄質も、飢餓時の生体応答に一定の役割を担っています。但し、交感神経系の関与の程度は、運動負荷や負傷の様な急に起きた事態に比べると大きくはありません。絶食開始後1週間は、交感神経系や副腎髄質から分泌されるアドレナリンやノルアドレナリンの量は、脂肪分解を促進する為に、上昇します。
低栄養への対応
■低栄養への対応の仕方
 エビデンスには乏しいですが、簡易方法としては、体重(←個々の患者さんの理想体重!(期待値)であって、現在のやせ細った状態での体重ではありません)1Kgあたり25~35Kcalとする方法があります。摂取する栄養素の構成は、炭水化物が45~70%、蛋白質が10~15%、脂肪が20~35%、それ以外にビタミン、ミネラル、食物繊維とするのが良いとされており、これ等は6大栄養素と呼ばれています。蛋白質については、低栄養の人では体重1Kgあたり、少なくとも0.6~0.8gの摂取が必要ですし、慢性炎症等の病気がある爺婆では、更に多くの摂取が望ましいとされています。
エビデンスには乏しいですが、簡易方法としては、体重(←個々の患者さんの理想体重!(期待値)であって、現在のやせ細った状態での体重ではありません)1Kgあたり25~35Kcalとする方法があります。摂取する栄養素の構成は、炭水化物が45~70%、蛋白質が10~15%、脂肪が20~35%、それ以外にビタミン、ミネラル、食物繊維とするのが良いとされており、これ等は6大栄養素と呼ばれています。蛋白質については、低栄養の人では体重1Kgあたり、少なくとも0.6~0.8gの摂取が必要ですし、慢性炎症等の病気がある爺婆では、更に多くの摂取が望ましいとされています。
■サルコペニアの予防とその為の蛋白質の摂取
筋肉等では絶えず一定量蛋白質の分解が起こっているものですが、蛋白質をロクに食べない状態が長期に亘ると、分解分の補充がなされず、筋肉量が減少して運動障害が発生します。低栄養状態が続くと、これまた、エネルギー源として筋蛋白質が消費され、更に筋肉量が減少して、運動障害に拍車が掛かります。所謂、サルコペニア(美容通信2019年2月号)って状態です。筋肉量が減少すると、血中グルコースの筋肉への取込み量は減少し、その余剰分となったグルコースは脂肪の合成に利用されます。
神経系や免疫系の細胞は、多くのエネルギーや蛋白質(アミノ酸)を必要とするので、グルコースや蛋白質の代謝に障害が起こると、それらの供給不足の為に、神経系による体の調節機能や、免疫系による体の感染防御機能や修復機能が低下します。ワクチン接種をしても、抗体が効率良く増加しない等の悪影響が見られます。
■適量の蛋白質摂取が大事~アミノ酸は貯蔵出来ない
厚生労働省の「日本人の食事摂取基準」では、標準体重の成人では、体重1Kg当たり約1.0gの蛋白質を摂取する必要があります。以前美容通信で何度も触れましたが、これが多くの人にとっては結構難題(美容通信2016年6月号)で、例えば体重50Kgの人が蛋白質を50g摂るとしましょう。鶏肉100gを食べれば十分おつりがくるかと言えばそんな訳はなく、100gの鶏肉の中には蛋白質が20g含まれています。生で鶏肉を食べる人なんていませんから、必ず加熱します。つまり、熱損傷を考慮する必要がありますから、×0.6。つまり、100gの鶏肉をソテーして食べても、蛋白質の摂取量は20g×0.6=12gしかなりません。単純計算で、417gの鶏肉を食べる必要がある…。大食漢のHISAKOは1日に400gくらいのお肉は平気で平らげてしまいます(笑)が、多くの、特に高齢者では、お食事だけで必要量を摂取するのはかなり以上の苦行になりかねません。ですから、上手にサプリメントってずるっこもありでしょう(美容通信2020年10月号)。
しかし、何事も適量が肝要で、多過ぎる蛋白質の摂取は腎臓の負担になります。腎臓は尿素を排出するだけでなく、尿素の素材となるアルギニンの合成を行い、肝臓に供給しています。ですから、適量が大切なんです。
蛋白質を十分に摂取して運動する事で、筋肉量を維持し、増加させる事が出来ます。アミノ酸は、筋蛋白合成を促進するシグナル伝達物質の働きをします。また、筋細胞以外の多くの細胞でも、新陳代謝が円滑に進行する様になります。例えば、運動のバランスを取る神経系、感染防御や組織修復に関わる免疫系と言った体の基本機能が担保されます。
病的ストレスと代謝応答
病原体に憑り付かれる(感染!)とか、外傷や熱傷、紫外線や電離放射線等の照射による物理的な攻撃で損傷を受けると、私達の体は炎症反応を引き起こし、ダメージからの素早い脱却と回復を試みます。
代謝的見地からこの炎症の特徴を表現すると、高血糖になります。転落事故等で多大な物理的なダメージを受けた時、初期(ショック期)には代謝が低下しますが、2~3日後には高血糖の時期に移行します。同時に、体温上昇、安静時エネルギー消費量の増加、体蛋白質(筋肉)の減少が認められます。
高血糖になる原因の一つとしては、アドレナリンやグルココルチコイド、グルカゴン等の、血糖値を上げるストレスホルモンの分泌が挙げられます。また、末梢組織で認められるインスリン抵抗性も、高血糖の原因となります。組織や細胞はストレスホルモンに応答し、グリコーゲンや脂肪、蛋白質の分解を起こし、それらの分解産物を素材としたグルコースの合成(糖新生)が促進されます。インスリン抵抗性=インスリンの効果低下により、末梢組織の細胞内へのグルコース取込み、つまり利用の減少が起こります。この合成の促進と利用の減少の両者の影響により、血糖値が上昇します。
敗血症
■負の免疫応答が重症化すると、敗血症になる
 私事ですが、3年前に、急性リンパ管炎から敗血症になり、死にかけました…。朝いつものように朝散歩して、普通に外来を開始したのですが、2時間後には歩けなくなり、3時間後には完全にダウンして、緊急入院。翌日から、免疫グロブリンの点滴を開始して、漸く生還したのですが、病原体に感染した時、私達は生体反応を引き起こし、治癒に向けた応答をします。その特徴は強力な炎症反応で、白血球(好中球、単球、マクロファージ等)が活性化されて盛んに細胞分裂を行うと共に、炎症性サイトカイン(IL-1、IL-6、TNF-α等)や、炎症急性期蛋白質(C反応性蛋白質等)を分泌します。これらの自然免疫系(顆粒球系)及び獲得免疫系(リンパ球系)の細胞が病原体の排除に働き、生体防御反応が感染に打ち勝つと、次の回復段階に移ります。炎症の抑制、免疫反応の抑制段階に進み、炎症は治まり、組織修復と再生の過程が始まります。
私事ですが、3年前に、急性リンパ管炎から敗血症になり、死にかけました…。朝いつものように朝散歩して、普通に外来を開始したのですが、2時間後には歩けなくなり、3時間後には完全にダウンして、緊急入院。翌日から、免疫グロブリンの点滴を開始して、漸く生還したのですが、病原体に感染した時、私達は生体反応を引き起こし、治癒に向けた応答をします。その特徴は強力な炎症反応で、白血球(好中球、単球、マクロファージ等)が活性化されて盛んに細胞分裂を行うと共に、炎症性サイトカイン(IL-1、IL-6、TNF-α等)や、炎症急性期蛋白質(C反応性蛋白質等)を分泌します。これらの自然免疫系(顆粒球系)及び獲得免疫系(リンパ球系)の細胞が病原体の排除に働き、生体防御反応が感染に打ち勝つと、次の回復段階に移ります。炎症の抑制、免疫反応の抑制段階に進み、炎症は治まり、組織修復と再生の過程が始まります。
しかし、この様な通常の(正の)免疫応答と異なり、異常な免疫反応が起こる事があります。これが重症化すると、全身性炎症反応症候群になる事があります。感染症によるものは敗血症と呼ばれます。免疫系が過剰に反応し、過剰な炎症性サイトカインが血液を介して全身に波及すると、血圧の低下や多臓器不全を引き起こし、死に至る…。現状では、致死率20~25%です。
■高血糖とインスリン抵抗性が生じる
敗血症の初期には血糖値の上昇が認められますが、ストレスの程度を反映している為、ストレス誘発性高血糖と呼ばれ、病態の予後指標の1つで、死亡率の上昇と関連しています。治療が困難な過程に陥落してしまうと、血糖値は低下し、生存自体に逆風が吹き荒れます。
HISAKOの様に敗血症から治癒/生還した患者さんと、不幸にも敗血症性ショックで亡くなってしまった患者さんを比較すると、後者の予後の悪い群では、グリコーゲン分解及び解糖系の亢進と高血糖、血液中の乳酸やケトン体の増加、脂肪酸のβ酸化やアミノ酸代謝の低下が認められます。
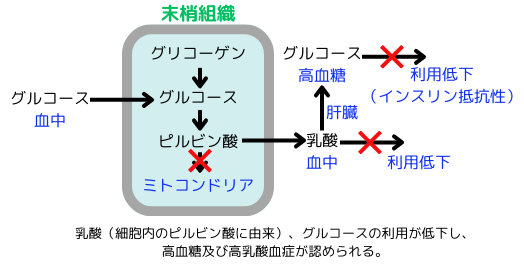 ■ピルビン酸の過剰とミトコンドリアの機能低下
■ピルビン酸の過剰とミトコンドリアの機能低下
敗血症では、グリコーゲン分解や血中からのグルコースの取込みが増加し、解糖系の亢進により多くのピルビン酸が合成されます。しかし、活性酸素等によりミトコンドリアに障害が発生すると、ピルビン酸がクエン酸回路に効率良く入れず、過剰となり、乳酸として血中に放出されてしまいます。乳酸の一部は肝臓に取り込まれてグルコースに変換され、血中に放出されます(コリ回路)。
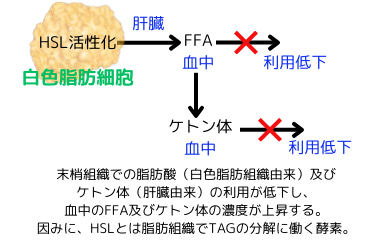 ■脂肪酸及びアミノ酸の血中濃度が上昇する
■脂肪酸及びアミノ酸の血中濃度が上昇する
敗血症では、遊離脂肪酸(FFA)及びトリアシルグリセロール(TAG)の血中濃度が、通常の4倍以上にもなります。この上昇は、脂肪組織にアドレナリンが作用し、ホルモン感受性リパーゼHSLが活性化されてFFAが放出される事、更には、筋肉等の末梢組織のインスリン抵抗性により、取込みと利用の低下が起こる為です。また、脂肪酸のβ酸化を促進する転写因子であるRPARαの活性が低下し、その結果、末梢組織での脂肪酸の分解(酸化)が抑制されます。
FFAの一部は肝臓に取り込まれ、ケトン体に変換されます。しかし、ケトン体も末梢組織での利用が抑制されている為、ケトン体の血中濃度が上昇し、その結果、ケトーシスになり、血液のpHの酸性度が高くなります。FFAやケトン体の量が多くなり過ぎると、毒性が現れ、器官が損傷されます。
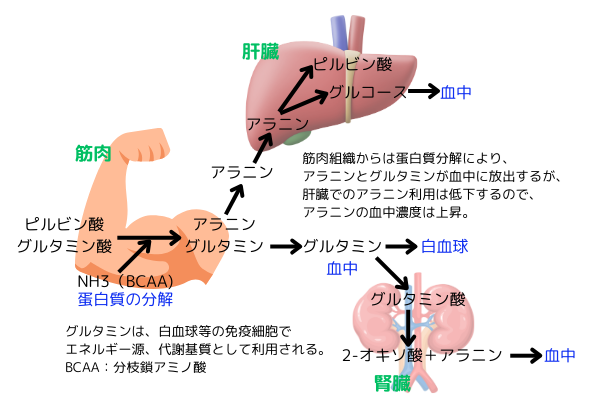 筋肉中のアミノ酸の量は、全ての種類で増加します。これは蛋白質の分解によるもので、アミノ酸を血中に放出し、エネルギー源として供給する為です。筋肉から放出されるアミノ酸の中で、特に重要なものはアラニンとグルタミンです。アラニンは肝臓に運ばれ、通常はピルビン酸を経てグルコース合成に利用されます。しかし、この回路が抑制されると、アラニンの血中濃度は上昇します。
筋肉中のアミノ酸の量は、全ての種類で増加します。これは蛋白質の分解によるもので、アミノ酸を血中に放出し、エネルギー源として供給する為です。筋肉から放出されるアミノ酸の中で、特に重要なものはアラニンとグルタミンです。アラニンは肝臓に運ばれ、通常はピルビン酸を経てグルコース合成に利用されます。しかし、この回路が抑制されると、アラニンの血中濃度は上昇します。
グルタミンは、グルタミン酸に、アミノ基転移反応によりアミノ基が付加されて合成されます。アミノ基を供与する代謝物質は、主に、分枝鎖アミノ酸(BCAA:ロイシン、イソロイシン、バリン)です。グルタミンのアミド基は、ヌクレオチドを合成する際の基質になり、免疫細胞等の細胞分裂に使用されます。アミノ基を供与したグルタミン酸は、グルタミン酸から2‐オキソグルタル酸に変換され、クエン酸回路に入り、エネルギー源及び細胞分裂に必要な脂質の合成反応の材料になります。
■好気的解糖により高乳酸血症がもたらされる
初期には高血糖になりますが、これは生体にストレスが掛かった時、神経系や免疫系の細胞にとって適した環境だからです。神経細胞の活動には多量のグルコースが必要ですが、白血球の様な免疫細胞の増加やサイトカイン合成にも、グルコースは必須です。
白血球(顆粒球)や活性化したリンパ球が盛んに細胞分裂を行う時に、好気的解糖(ワールブルグ効果)と呼ばれる経路で、グルコースが酸化されます。ピルビン酸から変換された乳酸が細胞外に放出されますが、体組織がこれを取り込んで利用(酸化)出来るだけの余力があれば問題はないのですが、処理能力を超えてしまうような場合は、敗血症の予後は悪くなります。つまり、乳酸の血中濃度は、敗血症の重症度の指標なんです。
外傷
■重度の外傷や手術後の生体応答
- ショック期の応答:代謝の低下
 外傷や熱傷等で生命の危機に陥る=ショック状態では、その殆どが血液量減少性ショックで、出血があれば止血し、そして、輸液や輸血で、出血や体液消失を補って救急対応を施します。心拍出量が減少して酸素供給量が減少し、また血圧が下がって体温が低下し、そして循環血液量を増やす為に血管収縮が起こります。酸素供給量減少により、ミトコンドリアの機能(美容通信2017年7月号)が低下するので、酸素を消費するクエン酸回路から嫌気性解糖へ鞍替えが一気に進みます。酸素不足により代謝は低く保たれ、基礎代謝率は低下します。
外傷や熱傷等で生命の危機に陥る=ショック状態では、その殆どが血液量減少性ショックで、出血があれば止血し、そして、輸液や輸血で、出血や体液消失を補って救急対応を施します。心拍出量が減少して酸素供給量が減少し、また血圧が下がって体温が低下し、そして循環血液量を増やす為に血管収縮が起こります。酸素供給量減少により、ミトコンドリアの機能(美容通信2017年7月号)が低下するので、酸素を消費するクエン酸回路から嫌気性解糖へ鞍替えが一気に進みます。酸素不足により代謝は低く保たれ、基礎代謝率は低下します。
- 異化が活発になり、高血糖になる時期が次のステージ
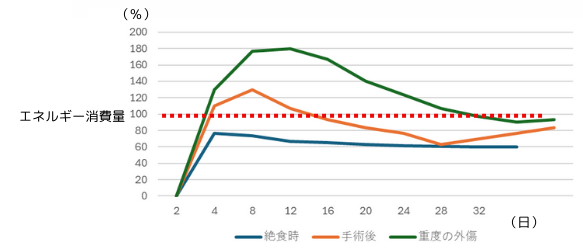 ショック期が過ぎると、次に起こるのは積極的な生体応答で、基礎代謝率が上昇し、生体内で異化過程が3~10日位続き、敗血症と同様に高血糖になります。グリコーゲン、TAG、蛋白質の全てに異化が認められます。
ショック期が過ぎると、次に起こるのは積極的な生体応答で、基礎代謝率が上昇し、生体内で異化過程が3~10日位続き、敗血症と同様に高血糖になります。グリコーゲン、TAG、蛋白質の全てに異化が認められます。
左図は、重度の外傷や手術後のエネルギー消費量の経時的変化を示しています。代謝が活発になり、異化過程で得られるエネルギーや代謝物質(合成されるアミノ酸や脂質等)を利用して、損傷の修復を行います。これは炎症の過程であり、免疫細胞が盛んに細胞分裂して活躍する時期に当たります。蛋白質の分解が亢進するので、生体の窒素バランスは負の方向に傾いた状態で、窒素を含む化合物が体外により多く排出されます。
肝臓は、グリコーゲン分解或いは糖新生によりグルコースを合成し、それを他の組織に供給しますが、グルコースの一部は肝細胞自身の蛋白質合成にも利用されます。肝臓は組織損傷ストレスに反応し、色々な蛋白質を合成し分泌しますが、その一つが、臨床的にストレス反応の程度評価として用いられるCRP(C反応蛋白質)です。
勿論、グルコースによるエネルギー産生だけではなく、限定的とは言え、脂肪も分解されてエネルギー供給に用いられます。エネルギー源の供給を円滑に行う為に、血液量が増加する必要があります。この様な生体応答には自律神経系やストレスホルモン(アドレナリン、グルココルチコイド、グルカゴン等)、増殖因子、インスリンが関与しており、これら全ての因子の分泌が増加します。
- 異化から同化過程への移行(治癒)
最後が、治癒に向かう過程です。損傷の治癒が上手く進行すると、10日ほどで異化過程から同化過程、即ちエネルギ源の回復期に移行します。この時期には、栄養療法や食事摂取により、十分な栄養素が得られる環境になっており、同化ホルモンである、インスリンやインスリン様増殖因子IGF-1の分泌が上昇します。その結果、蛋白質の合成も正常レベルまで回復し、蛋白質が十分に摂取さえされていれば、窒素バランスは負から性の方向に移行し、体外に排出される窒素よりも、体内に摂取される量が多くなります。
■病原体感染と物理的損傷に見られる類似点と相違点
外傷や熱傷で認められる生体応答は、感染に対する生体応答と非常に類似はしていますが、病原体は生きて増殖します。つまり、私達の栄養素を病原体と取り合う点が違います。また、免疫細胞は病原体をを抑え込もうと活発に働き、活性酸素(美容通信2017年10月号)を合成して放出します。活性酸素は細菌に対して毒素を発揮しますので、病原体抑制の一つの戦略となります。この活性酸素の合成にはNADPHを消費するオキシダーゼが働くので、それによりNADPHの消費が増加し、解糖系の亢進が要求されます。
癌
■癌患者にみられる痩せとサイコぺニア
 癌が進行して末期になると、多くの患者さんでは極端な痩せが出現します。その原因の一つは、食欲低下による食事の摂取不足ですが、癌は生物にとって異物であり、これを排除しようと絶えず免疫反応が起こっており、より多くのエネルギーが消費され、敗血症に類似する異化亢進状態にある為です。
癌が進行して末期になると、多くの患者さんでは極端な痩せが出現します。その原因の一つは、食欲低下による食事の摂取不足ですが、癌は生物にとって異物であり、これを排除しようと絶えず免疫反応が起こっており、より多くのエネルギーが消費され、敗血症に類似する異化亢進状態にある為です。
中でも、極端な痩せ(カヘキシー)は、癌の発症早期からみられることがありますが、これは筋肉及び脂肪組織の量が極端に減少した状態で、食事の摂取量や癌の増殖や進展の速度とは関連していません。癌細胞から放出される代謝物質やホルモンに関係しているのではないかと、考えられています。癌患者さんの約10%にカヘキシー(特に、膵臓癌等の消化器系の癌や肺癌に多い)が認められ、これが直接的な死因となります。
肥満
肥満は、健康や先月号で特集したED(美容通信2025年9月号)を含むQOL(生活の質)、医療と関連する社会的な関心事です。とりわけ、欧米諸国では肥満した人の割合が多く、糖尿病等の代謝疾患や心血管疾患、癌の有病率を上昇させる大きなリスク要因です。
エネルギーの摂取量が消費量を上回っている事が、肥満の第一原因です。摂食は食欲と関連していますが、エネルギー消費は代謝に関連します。遺伝性の肥満の解析から、エネルギー消費に関与する遺伝子はリスク因子の候補としては上がらず、食欲の促進を調節する遺伝子に変異が集中しています。つまり、消費量の減少よりも、摂取量の増加の方が重要と考えられており、対応策としてはカロリー摂取量の制限(及び積極的な運動)って事になりますが、実際問題としては、実行するのは非常に難しいのは皆様もよ~くご存じの通り…。
肥満には、上記の食事量だけでなく、食欲や食習慣に関連する遺伝要因やホルモン等も影響します。それは、1日の間の代謝リズムが体内の時計遺伝子(美容通信2025年1月号)の調節下にあり、食事の時間帯は時計遺伝子の働きに影響するからです。例えば、夜遅くに食事する習慣の様な食生活の時間帯の変化は、時計遺伝子の働きやリズムに影響を与えます。
肥満の病態
 ■肥満の原因と現代社会:1日4Kcalずつ食べ過ぎているらしい…
■肥満の原因と現代社会:1日4Kcalずつ食べ過ぎているらしい…
私達が消費するエネルギー量よりも食物摂取量が多くなると、余剰となったエネルギーが体内に脂肪として貯蔵され、その結果肥満になります。体内のエネルギー平衡のバランスがプラスに傾くと、肥満になるって話です。一般的な人達の体重の経過を追跡すると、25歳から75歳の間に約10Kg増加します。脂肪組織1Kgあたり、30MJのエネルギーを貯蔵出来るので、50年間で300MJのエネルギーを摂取し過ぎている、つまり、1日当たりに換算すると約16KJ(4Kcal)の食べ過ぎって勘定になります。
■肥満の評価法:BMIだけではない
肥満は、体内の脂肪量の増加なので、本来は脂肪組織の量を測定すべきですが、あまりにも煩雑なので、BMI(body mass index)の値で代用しています。子供には別の指数が存在しますが、成人ではBMIが国際的な指標として用いられています。
BMI = 体重kg ÷ (身長m)2
WHOの基準では、25~30だと過体重、30を超えると…、さすがに、自分でも、なるほどデブ!と実感せざる得なくなります。
脂肪の量だけでなく、皮下脂肪か内臓脂肪かと言う体内での脂肪組織の分布も重要です。この解剖学的部位の差異は、Ⅱ型糖尿病や心血管疾患の有病率に影響しますが、特に腹腔内の脂肪組織(内臓脂肪)の量は、臀部や下肢の脂肪組織の量よりも有病率に強く影響します。その為、ウエスト/ヒップ比の測定が、もう一つの肥満評価法として使用されています。男性では1.0以上、女性では0.9以上だと異常と判定されます。
■肥満が齎す。つまり脂肪組織が影響する疾患や症候群
肥満の外科的治療の効果について、スウェーデンでの興味深い報告があります。BMIが40以上の肥満の人に対し、脂肪組織を外科的に切除した群(約2000人)とそうでない対照群(約2000人)を比較した研究で、それによると、外科的治療群では20年後の体重が約18%(対照群では1%)減少し、心筋梗塞、脳卒中、糖尿病、癌等による死亡率が30%低下したそうです。つまり、過度の脂肪組織の存在は、色々な病気のリスク因子になる事が示唆されます。ですから、肥満治療の第一は食物摂取量を減らす事にあり、毎日の食物摂取を10%減らす事が推奨されています。
■肥満の人は、エネルギー摂取量だけでなく、消費量も多い
肥満の原因は、エネルギー摂取量が消費量よりも多い事にありますが、肥満している人は、摂取量と消費量のどちらも多く、食べ過ぎの状態でバランスが保たれています。肥満している人は痩せている人に比べ、安静時エネルギー消費量が約20%高くなっています。白色脂肪組織(美容通信2018年8月号)はエネルギーを殆ど消費しないので、増加した非脂肪組織(筋肉やその他の組織)が、その20%増加分のエネルギー消費の担い手になっています。
■肥満者の脂肪組織の病態~慢性炎症
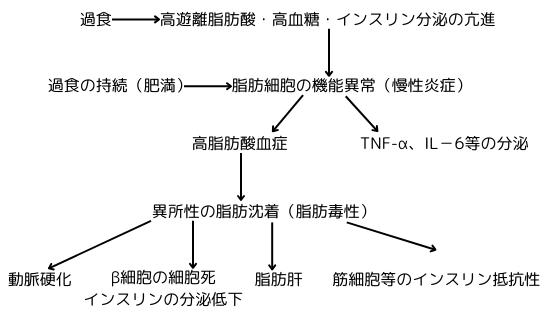 過食によるエネルギー過剰(生体にとっては、これも立派なストレス!)の状態が続くと、肥満になります。初期の段階では、インスリンやレプチン等のホルモンが過食に対して適切な対応をするので、問題は起こりません。白色脂肪組織が、コツコツと、地道に、過剰なエネルギーを脂肪細胞内に脂肪として貯金します。その結果、脂肪細胞に見られる脂肪滴のサイズは大きくなり、細胞自体も肥大化します。エネルギー過剰は、遊離脂肪酸、低密度リポ蛋白質、グルコースの血中濃度の上昇、インスリン分泌の亢進としても観察されます。
過食によるエネルギー過剰(生体にとっては、これも立派なストレス!)の状態が続くと、肥満になります。初期の段階では、インスリンやレプチン等のホルモンが過食に対して適切な対応をするので、問題は起こりません。白色脂肪組織が、コツコツと、地道に、過剰なエネルギーを脂肪細胞内に脂肪として貯金します。その結果、脂肪細胞に見られる脂肪滴のサイズは大きくなり、細胞自体も肥大化します。エネルギー過剰は、遊離脂肪酸、低密度リポ蛋白質、グルコースの血中濃度の上昇、インスリン分泌の亢進としても観察されます。
ところが、エネルギー過剰の状態が長期間持続し、脂肪組織の蓄積能を超過すると、脂肪細胞に機能異常が生じます。この異常は、脂肪組織内でのマクロファージ(美容通信2024年3月号)の増加、腫瘍壊死因子α(TNF-α)やインターロイキン6(IL-6)等の炎症性のサイトカイン(美容通信2021年8月号)の分泌により判断出来ます。即ち、脂肪細胞に慢性炎症(美容通信2021年1月号)が起きた状態です。
この状態では、遊離脂肪酸の取込みが低下するので、行き場を失って難民化した遊離脂肪酸は、筋肉や肝細胞と言った脂肪組織以外の細胞に、脂肪として身を寄せるしかなくなります。これを異所性の脂肪沈着と言います。筋肉では脂肪酸の利用(β酸化)が抑制され、本来ならば脂肪酸の増加に対し適切な対処を行うべき転写因子PPARαの活性化が起こらず、脂肪の沈着に拍車がかかります。グルコース代謝にも異常が生じ、グリコーゲンシンターゼ(合成酵素)や、グルコース由来のピルビン酸をアセチルCoAに変換するピルビン酸デヒドロゲナーゼの活性低下が起こり、これ等がインスリン抵抗性を惹起する原因の一つとなります。
肝臓に脂肪が蓄積すると、非アルコール性脂肪性肝疾患を引き起こしますし、脾臓のβ細胞に脂肪が蓄積するとインスリン分泌の低下と細胞死を誘発します。血管内皮細胞に脂肪が溜れば、そこにマクロファージが押し寄せ、動脈硬化の原因になります。これらの病態は慢性炎症と密接に関連していて、代謝されずに血中で無駄に血中濃度が上がってしまった遊離脂肪酸が、マクロファージの表面にあるアンテナのToll様細胞に結合してしまうと、そのシグナル伝達系が活性化され、結果、マクロファージから炎症性サイトカインが放出されます。
■様々な組織で慢性炎症が起こり、代謝記憶が生じてます
栄養過多の肥満者では、色々な組織に慢性炎症が起こっています。高カロリー食を食べさせ続けて、無理やりデブに肥やしたマウスでは成熟した単球や好中球(及び前駆細胞)に変化が認められます。その一つが、肥満に伴う慢性炎症に応答した遺伝子発現パターンへの変化です(再プログラミング)。興味深い事に、再プログラミングが前駆細胞で維持される、つまり、記憶されると言う事です。応答反応と言うものは、通常、時間単位や日単位の期間に於ける変化に過ぎませんが、シグナル伝達が記憶され、固定化されてしまうと、更に長期間の変化が齎されてしまいます。言い換えると、高カロリー食を低カロリー食に変更しても、元の遺伝子発現パターンに戻る事はなく、再プログラミングされた発現パターンが記憶され、固定化されるって事です。これはマウス特有の事象ではなく、人間様でも確認されています。代謝記憶metabolic memoryと呼ばれ、その分子機構はエピジェネティック効果(美容通信2024年1月号)によるものと考えられています。
肥満に影響する様々な要因
■概日リズムと肥満
- 時計遺伝子は遺伝子発現のリズムを作る
肥満の原因は、エネルギー摂取量が消費量よりも多い事にありますが、この摂取(消化過程を含む)や消費の基盤になっているのが代謝です。代謝に影響する因子としては、食事量や運動量、食事をする時間帯等があります。
私達は太陽が昇ると、本格的な活動を開始する前に朝食を摂り、活動が終了した後に夕食を摂ります。深夜は食事をしないのが普通です。その為、日中は血糖値が高くなり、夜間から早朝にかけて血糖値は低下します。それとは逆に、遊離脂肪酸の血中濃度は夜間に高くなります。この概日リズム(美容通信2019年10月号)を無視し、夜遅くに食事をするような生活が習慣になると、肥満のリスクが増大します(美容通信2025年1月号)(美容通信2020年5月号)。
- 時計遺伝子が脂肪組織の代謝を微調整
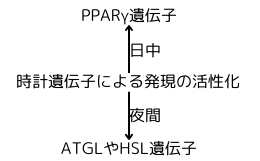 白色脂肪組織や褐色脂肪組織等でも、時計遺伝子の調節を受ける遺伝子群、例えば、脂肪代謝に働く脂肪組織トリアシルグリセロールリパーゼ(ATGL)やホルモン感受性リパーゼ(HSL)、PPARγをコードする遺伝子等ですが、概日リズムに従った発現をします。
白色脂肪組織や褐色脂肪組織等でも、時計遺伝子の調節を受ける遺伝子群、例えば、脂肪代謝に働く脂肪組織トリアシルグリセロールリパーゼ(ATGL)やホルモン感受性リパーゼ(HSL)、PPARγをコードする遺伝子等ですが、概日リズムに従った発現をします。
夜間(マウスは人と昼夜逆転している動物なので、活動期、つまり人間の昼間に相当!)には、ATGL(脂肪の分解)やHSL(遊離脂肪酸の産生)の様なリパーゼをコードする遺伝子の発現が上昇し、組織に脂肪酸を供給する手助けをしています。一方、日中(非活動期!)には、それらの発現の低下と、PPARγをコードする遺伝子の発現上昇が起こります。PPARγには、脂肪組織や肝臓でインスリン感受性を高め、グルコースの取込みを増やす働きがあり、グルコースを原材料とした脂肪酸の合成促進、脂肪の貯蔵に代謝を後押しします。
時計遺伝子の塩基配列の一部が欠損したマウスでは、脂肪酸代謝に関与する遺伝子群の発現パターンに変化が認められます。mRNA発現量の周期性が失われ、脂肪組織から脂肪酸を放出する過程が上手く進まず、その結果、脂肪の異化が低下、脂肪酸や脂肪合成が亢進し、早々と肥満になってしまうそうです。時計遺伝子による脂肪代謝の調節は、時間単位(長時間)の変化をもたらす為、代謝の微調整と言う役割を担っていると考えれています。
- 代謝が時計遺伝子に影響
食事の時間帯による代謝産物の変動も、時計遺伝子に影響をします。肥満を招くような時間帯に食事をすると、概日リズムが減弱します。反対に、規則正しい食事(と低カロリー食)は概日リズムを活性化させ、肥満防止に役立ちます。
- 褐色脂肪細胞の概日リズム
褐色脂肪細胞(美容通信2018年8月号)は、新生児期には認められますが、成長に伴って減少し、大人になるとないか、あったとしても極く微量で、その生理的な意義は無視出来ると、長らく定説とされておりました。が、最近の行術の進歩(FDG-PET/CT)に伴って、大人にもちゃんと褐色脂肪細胞があり、夏には褐色脂肪が検出されなかった人でも、冬になると検出されるようになったりと、褐色脂肪の消長は一方向性ではなく、条件次第で再び機能が高まる可逆的変化をしている事が分かっています。また、褐色細胞組織の活動は、大きな日内変動を示す事が分かっています。グルコース輸送体のGLUT4や、熱発生に関与するミトコンドリア蛋白質である脱共役蛋白質1(UCP1)をコードする遺伝子は、概日リズムに従った発現変動が認められますし、褐色脂肪細胞の代謝と言う面では、TAG由来の遊離脂肪酸の取込み量には日内変動があります。
食欲に影響するホルモン
- 食欲を抑制するレプチン
食欲を抑制する因子の一つに、レプチン(美容通信2018年9月号)と言うペプチドホルモンがあります。痩せると言う意味のギリシャ語に由来するこのホルモンは、脂肪細胞から分泌され、血流に乗って視床下部に作用します(短鎖脂肪酸(美容通信2024年8月号)にはレプチン分泌促進作用がありますが、HISAKOのKIRINのうんこ検査では、短鎖脂肪酸生成菌は日本人に多く見られる細菌の一つとは言われていますが…、壊滅状態だった(笑))。レプチンは脂肪代謝には直接影響を及ぼさないので、エネルギー消費を亢進させてくれる様な💛な効果はなく、食欲を抑制するだけと言う事が分かっています。
BMIの異なる人達を対象にしたレプチンの血中濃度を測定すると、BMIとレプチンの濃度は相関をしているので、脂肪組織の多い肥満者では食欲を抑制するレプチンの分泌されているにもかかわらず、その効果が現れていないと考えられます。Ⅱ型糖尿病ではインスリンの効果が減弱しており、この状態をインスリン抵抗性と言いますが、同様に肥満者にはレプチン抵抗性と言う病態があるとされています。
- 食欲に影響するその他のホルモン
膵臓から分泌されるインスリンは、食欲を抑制するもう一つの因子とされ、レプチンと共に食欲の長期的な調節、つまり、エネルギー状態の高低を脳に伝える事に関与しています。
食欲を調節する消化管由来のホルモンとしては、胃から分泌されるグレリンや、腸から分泌されるPYY3-36がありますが、これ等は食事による結果(状態)を脳に伝える事(短期的調節)に関与しています。前者のグリシンは、胃が空になると分泌され、視床下部に作用し、食欲促進に働きます。後者のPYY3-36は、十分に食事が摂取されたというシグナルを消化管細胞から視床下部に伝達し、食欲抑制に働きます。
- 食欲を調節するホルモンは視床下部に作用
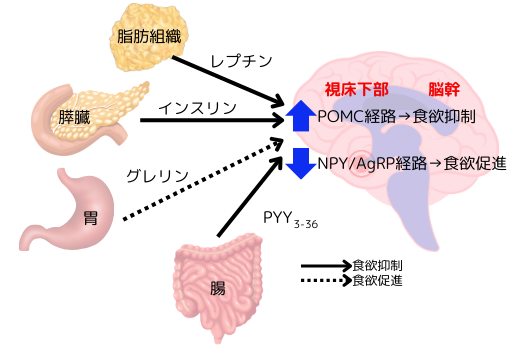 左図は、食欲を調節するホルモンと、その視床下部での作用を示しています。レプチンの受容体は、視床下部に存在する2種類の神経細胞で発現しています。一つは、満腹中枢に存在するプロピオメラノコルチン(POMC)神経細胞、もう一つは、食欲中枢に存在するニューロペプチドγ(NPγ)/アグーチ関連ペプチド(AgRP)神経細胞で、これ等は視床下部に存在する一次神経系の役割を担っています。
左図は、食欲を調節するホルモンと、その視床下部での作用を示しています。レプチンの受容体は、視床下部に存在する2種類の神経細胞で発現しています。一つは、満腹中枢に存在するプロピオメラノコルチン(POMC)神経細胞、もう一つは、食欲中枢に存在するニューロペプチドγ(NPγ)/アグーチ関連ペプチド(AgRP)神経細胞で、これ等は視床下部に存在する一次神経系の役割を担っています。
これらの2種類の神経系細胞は、レプチンのみならず、インスリンの受容体も発現していますし、NPγ/AgRP神経細胞に至っては、更に、グリシンとPYY3-36の受容体も発現しています。食事に関する多種類の情報が、この視床下部で統括されているんです。
これら2種類の神経細胞に発現している受容体にレプチンが結合すると、ROMC神経細胞からはα‐メラニン細胞刺激ホルモンと言う神経伝達物質が分泌され、NPγ/AgRP神経細胞からはNPY及びAgRPと言う神経伝達物質が分泌されます。これらの分泌の促進や抑制により、二次神経系(脳幹にある食欲抑制性神経系と食欲促進系神経系)の細胞に情報が伝達されます。
肥満に影響する遺伝要因:エネルギー代謝系の関与は小さい
肥満の発症には、遺伝要因(美容通信2010年3月号)の影響は大きくはない(5%以下)ですが、ある事はあります。食欲を抑制する神経系で働く遺伝子群には、肥満のリスクと関連する遺伝子変異が認められています。しかし、エネルギー消費に働く遺伝子に、変異は検出されていません。
肥満をもたらす遺伝的な要因は多因子性で、レプチンをコードする遺伝子の様な単一遺伝子の変異頻度は非常に低く、また、頻度の高いバリアントの効果は小さいとされています。ですから、実際に肥満になるかどうかを決定するのは、遺伝的要因と言うよりも環境要因(食事量と運動量)です。
糖代謝の異常
糖尿病は、年を取るに従い発症率がじわじわ上昇。世界的には20歳以上の人の約9%が罹患しており、日本では5%以上とされています。名は体を表すと言いますが、糖の血中濃度が常に高くなっている為、おしっこにまで糖が溢れ出す病気ですが、病状がかなり進行しないと、おしっこに蟻が集る程に甘くなるなんて事はありません。一般的なⅡ型糖尿病ではこれ!と言った自覚症状はなく、会社の健康診断で指摘されて、初めて気が付くってパターンが多いようです。
血糖値を調節するホルモンは多数ありますが、血糖値を下げる効果があるのはインスリンだけです。つまり、インスリンの効果が不十分だと高血糖になり、それが持続すると糖尿病になります。
糖尿病の患者さんの多くは既に何らかの治療を受けており、今では、急性のインスリン欠乏で死ぬ事は殆どなくなりましたが、糖尿病性合併症が誘発される事による、先月号でも特集した難治性のED(美容通信2025年9月号)を始めとするQOLの低下や寿命の短縮が問題となります。糖尿病合併症は血管性の病変によるものが主で、微小血管の障害では、陰茎や腎臓、目、神経系に異常が認められ、大きな血管の障害では冠動脈や脳動脈の虚血性疾患、高血圧があります。癌の発症率も上昇します。
Ⅰ型糖尿病とⅡ型糖尿病
 Ⅰ型糖尿病は、自己免疫疾患です。嘗てはインスリン依存型糖尿病と呼ばれていました。遺伝的な素因に、ウィルス感染等の引き金となる環境要因が加わり、β細胞に対する自己抗体が産生され、インスリン分泌が障害されます。インスリン補充療法は必須で、痩せ型で、若い年齢層で発症します。
Ⅰ型糖尿病は、自己免疫疾患です。嘗てはインスリン依存型糖尿病と呼ばれていました。遺伝的な素因に、ウィルス感染等の引き金となる環境要因が加わり、β細胞に対する自己抗体が産生され、インスリン分泌が障害されます。インスリン補充療法は必須で、痩せ型で、若い年齢層で発症します。
Ⅱ型糖尿病の主な病態は、インスリンが分泌されても体内の組織が上手く応答出来ない状態で、受け手側の細胞に問題があります。これはインスリンに対する感受性が低下しているインスリン抵抗性(美容通信2025年6月号)の状態で、病状が進行すると、β細胞が疲弊してインスリンの分泌が低下し、インスリン欠乏状態に陥ります。こうなるとインスリン補充療法は必須で、通常は肥満しており、年齢は30歳以上です。
■Ⅱ型糖尿病にみられる代謝異常
- 背景にあるメタボリックシンドローム
インスリンの効果が減弱して、その結果、高血糖になるのがⅡ型糖尿病です。Ⅱ型糖尿病のリスク因子には、人種や家族歴と言った遺伝的要因や生活習慣等数多くありますが、代謝って視点ではメタボリックシンドローム(美容通信2025年6月号)って背景が存在します。この状態では、1日の生活サイクルを通じたグルコースと脂肪酸の利用選択にも異常が認められ、代謝の柔軟性が低下しています。
- インスリン抵抗性
インスリン抵抗性とは、インスリンが持つ血中グルコース濃度を低下させる作用に対する、細胞の応答性が減弱してしまう事で、細胞のインスリン感受性の低下と換言出来ます。しかしながら、何故そんな事態が起こってしまったのか、未だ、良く分かっていません。唯、インスリン抵抗性は肥満と密接に関係していて、体内のエネルギーバランスがエネルギー過剰に傾いている状態で起こります。その為、内臓脂肪の増加によるウエストサイズの伸長、脂質異常症、肝臓での脂肪沈着が認められます。
インスリン抵抗性の初期段階では、体組織がより多くのインスリンを要求する状態となり、高インスリン血症になります(但し、インスリンンの効果がまだ残っている間は、血糖値の上昇は認められません)。この高インスリン血症は、適切な運動や食事制限、減量により改善可能です。しかし、不幸にしてその状態が持続すると、膵臓のβ細胞に負荷がかかり、損傷が起こり、インスリン分泌低下が齎され、インスリン抵抗性を更に悪化させる環境になります。その結果、耐糖能異常が認められるようになり、Ⅱ型糖尿病の発症に至ります。
高インスリン血症の状態では、脂肪合成の過程に異常が認められ、色々な代謝中間体が細胞内に蓄積します。筋肉内には脂肪酸が蓄積し、肝臓ではTAGの蓄積、脂肪組織ではその両者とされています。脂肪酸やTAGには毒性があるので、これが細胞のストレスになり、インスリンのシグナル伝達系に異常を引き起こしたと考えられ、この異常がインスリン抵抗性の本態です。しかし、このインスリン抵抗性が、どの臓器や組織で始まるのか…未だに良く分かっていません。
- 脂肪酸とケトン体の血中濃度が上昇
脂肪酸の血中濃度も、上昇します。通常、夜間のエネルギー供給は、グルコースより脂肪酸への依存度が高まるものですが、糖尿病の人ではこの比ではなく、夜間の脂肪酸の血中濃度が、筋肉組織での脂肪酸消費が低下している為に、健常人の4倍程度まで上昇します。この様な状態の患者さんが高脂肪食を摂取すると、血糖値の上昇と共に、筋肉組織等での脂肪酸の取込みが低下し、脂肪酸の血中濃度が上昇します。
肝臓では、細胞内の脂肪酸濃度が上昇し、過剰な脂肪酸はグリセロールとエステル化してTAGとなり、最終的にはVLDLとなります。このVLDLは血中に放出されるので、高VLDL(高TAG)血症になります。
Ⅰ型糖尿病程ではありませんが、肝臓で過剰になった脂肪酸はケトン体に変換される為、ケトン体の血中濃度も上昇します。しかし、Ⅰ型糖尿病と異なり、Ⅱ型では一定のインスリン分泌はあるので、ケトン体形成は抑制されますから、感染等の代謝ストレスが加わらない限りは、ケトアシドーシスの危険性は0ではありませんが、低くなります。
- ミトコンドリア機能低下により細胞は飢餓状態に陥る
Ⅱ型糖尿病の患者さんの組織は、グルコースや脂肪酸、ケトン体と言ったエネルギー源を上手く酸化出来ず、エネルギーの産生を担うミトコンドリア(美容通信2017年7月号)の機能低下が起こり、その結果、細胞は飢餓状態(美容通信2025年6月号)になってしまいます。
ミトコンドリアは、アセチルCoAを出発点とし、クエン酸回路を経て酸化的リン酸化に至るエネルギー産生の過程を担っていますが、その数やサイズが減少し、ミトコンドリアDNAの複製能も低下してしまいます。蛋白質レベルでは、酸化的リン酸化の過程で働く酵素複合体蛋白質の発現低下、ミトコンドリア機能調節の鍵となるPGC-1αの発現量の低下が見られます。PGC-1αの発現低下には、遺伝子プロモーター領域のエピジェネティック効果が関与(美容通信2022年7月号)(美容通信2024年1月号)しています。
■糖尿病は、グルコースだけの代謝異常ではない
繰り返しになりますが、Ⅰ型及びⅡ型糖尿病は、インスリンの欠乏、又はその効果の減弱によって起こる病気です。インスリンは、グルコースだけでなく、脂肪酸やアミノ酸の代謝にも影響しており、代謝物質全体の有効利用に働くホルモンです。
遺伝要因やエピジェネティック効果の影響
■糖尿病の遺伝要因:リスク遺伝子による素因
Ⅰ型及びⅡ型の糖尿病はどちらも発症に遺伝的な素因が関与しますが、後者のⅡ型糖尿病の発症の方がより強い関与が知られています。一卵性双生児では、1人がⅡ型糖尿病の場合、片割れのもう一人が発病するリスクはほぼ100%です。
■代謝記憶とエピジェネティック効果
生体への一つのストレスである高血糖が持続すると、色々な組織の細胞がその環境変化に応答し、遺伝子の発現パターンを変化させます。インスリン抵抗性の詳細は未だ良く分かってはいませんが、これも応答反応の一つで、ストレスに応答して遺伝子発現の再プログラミング(発現パターンの変化)が起こりますが、その変化は固定されてしまう事があり、代謝記憶と呼ばれます。
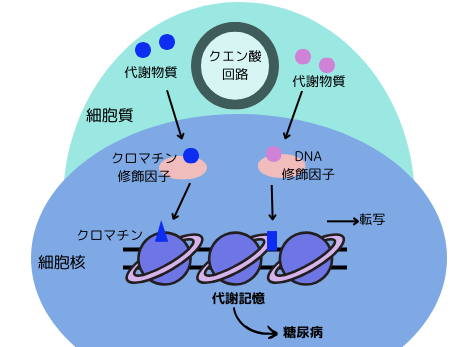 右図を見て下さい。例えば、栄養素と言った、細胞外部からのシグナル刺激の強さが変化したとします。栄養素が細胞内で代謝され、その代謝物質の一部(●●)は、核内のクロマチン修飾因子やDNA修飾因子に結合し、クロマチン構造を変化させます。即ち、DNAのメチル化(■)(美容通信2024年5月号)やヒストン修飾(▲)(美容通信2022年7月号)が齎されます。その結果、クロマチンのアクセシビリティが変化し、遺伝子発現のオン/オフの調節が変化してしまいます。シグナル刺激が続けば、クロマチン構造は変化したまま戻らなくなり、例え刺激が解除されても、リセットされません。記憶されてしまいます。
右図を見て下さい。例えば、栄養素と言った、細胞外部からのシグナル刺激の強さが変化したとします。栄養素が細胞内で代謝され、その代謝物質の一部(●●)は、核内のクロマチン修飾因子やDNA修飾因子に結合し、クロマチン構造を変化させます。即ち、DNAのメチル化(■)(美容通信2024年5月号)やヒストン修飾(▲)(美容通信2022年7月号)が齎されます。その結果、クロマチンのアクセシビリティが変化し、遺伝子発現のオン/オフの調節が変化してしまいます。シグナル刺激が続けば、クロマチン構造は変化したまま戻らなくなり、例え刺激が解除されても、リセットされません。記憶されてしまいます。
Ⅱ型糖尿病の合併症の一つである糖尿病性腎症についての大規模試験によれば、代謝記憶の存在が示されています。高血糖や高TAG血症と言った外部からのシグナル刺激が長期間に亘って続くと、糖尿病性腎症の発症に関連する遺伝子のクロマチン修飾(美容通信2022年7月号)に変化が見られ、その変化が記憶されます。
- エピジェネティック効果(美容通信2024年1月号)
生体内の殆ど全ての細胞には同一のゲノムが存在しますが、細胞の表現型(形態や機能)は、細胞によって遺伝子発現が異なる為、肝細胞や神経細胞、血球細胞等々と、多種多様に異なります。
遺伝子発現機構は、転写と翻訳から成り立っています。しかしその過程は数多くの因子やシステム(一連の因子群)が関連し合って発現調整に関わっており、複雑怪奇。正に魑魅魍魎(笑)。このネットワークを構成する因子には、DNA塩基配列上のプロモーターやエンハンサー、DNAに結合する蛋白質、DNAを取り囲むクロマチン蛋白質等があります。クロマチン構造は転写因子のアクセシビリティー(転写因子の接近のしやすさ)を調節しますが、この調節には、クロマチンを構成するヒストン蛋白質の修飾(アセチル化やメチル化等)や、DNAのメチル化等が関与します。この様なクロマチン構造の変化による遺伝子発現への影響を、エピジェネティック効果と言います。
遺伝子発現の調節には、長期的に維持されるものと短期的なものがありますが、どちらも転写因子とクロマチンの構造が関与します。環境の変化によりシグナルが変化した時などは、短期的な遺伝子発現の調節が働き、細胞は即時に、つまり時間単位で応答をします。しかし、この短期的な調節パターンは、短時間で終了するだけでなく、前述の様に長期化する事があります。例えば、高栄養状態やストレス等の特定の外部環境が持続した時には、白血球を含む多くの組織でクロマチン修飾に変化が起こり、外部環境が元に戻っても、その修飾パターンが長期間持続する、つまり記憶される事が知られています。
関連ページ
関連するHISAKOの美容通信をピックアップしました。
来月号の予告
骨盤臓器脱の保存的治療のゴールデンスタンダード。
<ペッサリー>