HISAKOの美容通信2024年6月号
腸活のすすめ~粘膜免疫から考える腸内細菌叢
 体内と外界の境界で働く粘膜免疫は、ウィルス等の感染性微生物の排除と常在微生物との共生と言う相反する業務を同時に担っています。しかしながら、この巧妙なバランスが崩れると、生体防御免疫が弱まり、外来微生物への感染リスクが高まったり、本来共生すべきはずの常在細菌や食事性抗原等に対して、強い免疫反応をお引き起こし、炎症性腸疾患や食物アレルギー等の病気の発症に繋がります。この複雑かつ巧妙なシステムの要にあるのが、腸内細菌叢です。腸内細菌叢への介入は、近年、アンチエイジング/若返りリジュビネーションに対する、エビデンスのある治療の代表格としても注目されています。
体内と外界の境界で働く粘膜免疫は、ウィルス等の感染性微生物の排除と常在微生物との共生と言う相反する業務を同時に担っています。しかしながら、この巧妙なバランスが崩れると、生体防御免疫が弱まり、外来微生物への感染リスクが高まったり、本来共生すべきはずの常在細菌や食事性抗原等に対して、強い免疫反応をお引き起こし、炎症性腸疾患や食物アレルギー等の病気の発症に繋がります。この複雑かつ巧妙なシステムの要にあるのが、腸内細菌叢です。腸内細菌叢への介入は、近年、アンチエイジング/若返りリジュビネーションに対する、エビデンスのある治療の代表格としても注目されています。
別に、第二の腸内細菌叢ブームではないとは思いますが、便検査(腸内細菌叢)の検査内容が、大昔の様な、善玉、悪玉、日和見の比率位しか分からなかった時代から飛躍的に進化し、実際に介入しやすい分野(美容通信2024年1月号)(美容通信2024年8月号)となりつつあります。腸内細菌叢の奥の深さを、粘膜免疫の観点からまとめてみました。
境界線上のホライゾン?
境界線上の絶妙な匙加減を司る「粘膜免疫」
 消化管や呼吸器等を始めとする粘膜組織は、体内と外界との境界に位置し、粘膜免疫と呼ばれる全身性免疫とは異なる特殊な免疫系が発達しています。粘膜免疫は、様々な方法で病原体の侵入や増殖を阻止し、また、炎症性免疫反応を誘導する事で病原体の排除を促進します。しかしながら、同時に、粘膜組織には、食事由来の抗原や常在微生物叢等の非病原性の環境物質も存在しています。これらの抗原は非自己ではありますが、生体の恒常性に必須の役割を果たしていますし、食事由来の栄養素は生きて行く上には必須です。更には、共生微生物は、栄養素の消化吸収や病原性微生物に対する競合、粘膜免疫系の発達等多岐に亘る役割を担っています。これ等の有益な非自己物質に対しては、病原体に対する様な炎症性免疫反応を起こさずに、抗炎症的な免疫応答や免疫寛容を誘導して共存関係を維持しているのです。つまり、外来物質に対して、「排除」と「共生」と言う相反するタスクを同時に担っているんです。ところが、この微妙なバランスが崩れると、生体防衛免疫が弱まって、外来微生物への感染リスクが高まったり、本来共生すべき常在細菌や食事性抗原等に対して過剰に反発して強い免疫反応を引き起こし、炎症性腸疾患や食物アレルギー等のろくでもない病気の発症に繋がります。
消化管や呼吸器等を始めとする粘膜組織は、体内と外界との境界に位置し、粘膜免疫と呼ばれる全身性免疫とは異なる特殊な免疫系が発達しています。粘膜免疫は、様々な方法で病原体の侵入や増殖を阻止し、また、炎症性免疫反応を誘導する事で病原体の排除を促進します。しかしながら、同時に、粘膜組織には、食事由来の抗原や常在微生物叢等の非病原性の環境物質も存在しています。これらの抗原は非自己ではありますが、生体の恒常性に必須の役割を果たしていますし、食事由来の栄養素は生きて行く上には必須です。更には、共生微生物は、栄養素の消化吸収や病原性微生物に対する競合、粘膜免疫系の発達等多岐に亘る役割を担っています。これ等の有益な非自己物質に対しては、病原体に対する様な炎症性免疫反応を起こさずに、抗炎症的な免疫応答や免疫寛容を誘導して共存関係を維持しているのです。つまり、外来物質に対して、「排除」と「共生」と言う相反するタスクを同時に担っているんです。ところが、この微妙なバランスが崩れると、生体防衛免疫が弱まって、外来微生物への感染リスクが高まったり、本来共生すべき常在細菌や食事性抗原等に対して過剰に反発して強い免疫反応を引き起こし、炎症性腸疾患や食物アレルギー等のろくでもない病気の発症に繋がります。
■粘膜免疫の部位特異性
粘膜組織は、体内の様々な部位に分布しており、夫々の粘膜組織を取り巻く外環境は当然異なりますから、粘膜免疫系と共生微生物叢はその環境に最適化したエコシステムを構築しています。例えば、常在細菌や食事由来物質等の常在抗原の種類や量は、粘膜の部位によっても大きく異なりますし、酸性度や酸素分圧等の環境も部位毎に大きく異なります。他にも、口腔粘膜では、咀嚼による機械的な刺激が免疫細胞の分化調節に関わっており、多彩な組織特異的免疫制御因子が報告されています。
| 口腔粘膜 | 呼吸器粘膜 | 胃粘膜 | 腸管粘膜 | |
| pH | 中性 | 中性 | 低い | 中性 |
| 常在細菌 | 多い | 少ない | 少ない | 多い |
| 酸素分圧 | 高い(歯周ポケット等では低い) | 高い | 低い | 低い |
| その他 | 咀嚼による機械的ストレス | 食事性抗原多い |
■異所粘膜組織間ネットワーク
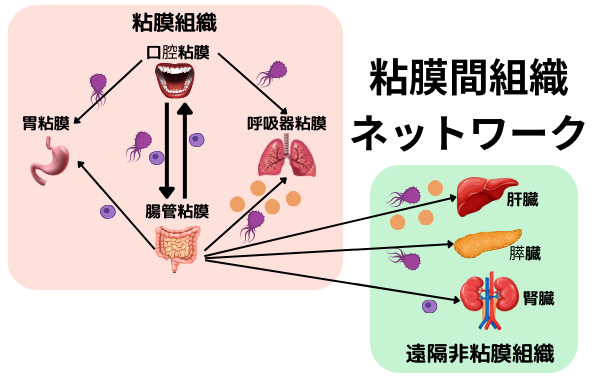 夫々の粘膜組織には部位特異的な免疫系と微生物叢が発達しており、固有の共生システムが確立しています。一方で、異所粘膜組織間には、粘膜免疫・常在微生物を介したネットワークが存在しています。例えば、右図の如く、腸管粘膜組織で分化誘導された免疫細胞や常在細菌代謝物が、様々な遠隔臓器(口腔や呼吸器と言った異所粘膜組織、並びに肝臓、膵臓、腎臓等の非粘膜臓器)へ移動し、異所での炎症誘導等に関与する事が知られています。他にも、口腔粘膜常在細菌や口腔粘膜で分化誘導された炎症性免疫細胞が、腸管粘膜へ移行し、炎症性腸疾患や大腸癌等の病態に寄与している事が分かっており、臓器関連・粘膜組織関連は、様々な病気の病態に関与しているようです。
夫々の粘膜組織には部位特異的な免疫系と微生物叢が発達しており、固有の共生システムが確立しています。一方で、異所粘膜組織間には、粘膜免疫・常在微生物を介したネットワークが存在しています。例えば、右図の如く、腸管粘膜組織で分化誘導された免疫細胞や常在細菌代謝物が、様々な遠隔臓器(口腔や呼吸器と言った異所粘膜組織、並びに肝臓、膵臓、腎臓等の非粘膜臓器)へ移動し、異所での炎症誘導等に関与する事が知られています。他にも、口腔粘膜常在細菌や口腔粘膜で分化誘導された炎症性免疫細胞が、腸管粘膜へ移行し、炎症性腸疾患や大腸癌等の病態に寄与している事が分かっており、臓器関連・粘膜組織関連は、様々な病気の病態に関与しているようです。
■粘膜免疫を制御し、病気を予防する
粘膜免疫は、生体防衛、恒常性維持に必須な役割を担っています。その為、粘膜免疫に手綱を付けて乗りこなせる者が、様々な病気も制御出来ると考えられています。例えば、粘膜免疫の強化による感染防御。粘膜組織は様々な病原体の侵入口である為、粘膜組織に適切な免疫応答を誘導する事で、病原体感染を防ぎ、同時に速やかな排除をも促します。また、粘膜免疫の調節因子としての「食事」も注目されています。例えば、食事の中に含まれる脂肪やショ糖等が、直接、或いは腸内細菌を介して、腸管粘膜免疫のバランスを破綻させ、炎症性免疫優位な状態にする為、肥満や糖尿病等の代謝性疾患の発症のリスクがUPします。反対に、食物繊維や発酵食品等は、腸内細菌や腸管粘膜免疫のバランスを改善し、代謝性疾患や炎症性疾患のリスクを下げ、病原菌感染防御能をUPする事も知られています。また、粘膜臓器間のネットワークを利用すれば、例えば、腸管の粘膜免疫を調節する事で、異所粘膜や非粘膜遠隔臓器に於ける病気の予防や治療も可能になるかも知れません。
粘膜免疫と微生物が介在する臓器間ネットワークと疾患
近年の科学技術の進展により、私達人間の宿主細胞を凌駕する多種多様な微生物の集団(微生物叢)が私達の体には存在し、その大半が粘膜組織に存在しています。中でも、腸粘膜組織は、人体に於ける最大の粘膜組織、且つ最大の微生物叢を有しています。これまでの研究により、特に腸内の粘膜免疫と微生物叢との相互作用が、腸局所での相互作用の域を超えて、全身の遠隔臓器の恒常性の維持と破綻に深く関わっている事が分かっています。
腸と全身の健康;正の関係
 私達の体には、100兆を超える微生物が棲みついており、体の部位ごとに異なる環境に適応し、夫々の部位で特徴的な微生物叢を構築し、宿主細胞と共に複雑なエコシステムを形成しています。中でも、腸管には1000種を超える腸内細菌が存在し、一宿一飯の恩義ではありませんが、宿主から生息場所の提供を受ける対価として、栄養の分解吸収、宿主免疫の教育、そして腸管外からの微生物の定着阻止等々と、宿主の恒常性維持に不可欠な役割を担っています(美容通信2020年6月号)。更には、腸内微生物叢は、巨大な内分泌臓器としても機能しています。例えば、人間の神経回路を動かすセロトニンやドーパミン(美容通信2014年1月号)等の神経伝達物質の多くは、腸内細菌から直接若しくは間接的に供給されています。同様に、食欲を司るグレリン(美容通信2023年7月号)(美容通信2019年2月号)(美容通信2018年9月号)やレプチン等のホルモンも、腸内細菌依存的な制御を受けています。ある種の腸内細菌群が炭水化物や蛋白質を分解して生成する短鎖脂肪酸(美容通信2024年1月号)は、前述のホルモン産生の制御に加え、上皮組織のバリア機能の制御や免疫細胞の分化を抑制する事で、腸管局所だけでなく、脳みそや肝臓を含め、多くの遠隔臓器の恒常性維持に関与しています。
私達の体には、100兆を超える微生物が棲みついており、体の部位ごとに異なる環境に適応し、夫々の部位で特徴的な微生物叢を構築し、宿主細胞と共に複雑なエコシステムを形成しています。中でも、腸管には1000種を超える腸内細菌が存在し、一宿一飯の恩義ではありませんが、宿主から生息場所の提供を受ける対価として、栄養の分解吸収、宿主免疫の教育、そして腸管外からの微生物の定着阻止等々と、宿主の恒常性維持に不可欠な役割を担っています(美容通信2020年6月号)。更には、腸内微生物叢は、巨大な内分泌臓器としても機能しています。例えば、人間の神経回路を動かすセロトニンやドーパミン(美容通信2014年1月号)等の神経伝達物質の多くは、腸内細菌から直接若しくは間接的に供給されています。同様に、食欲を司るグレリン(美容通信2023年7月号)(美容通信2019年2月号)(美容通信2018年9月号)やレプチン等のホルモンも、腸内細菌依存的な制御を受けています。ある種の腸内細菌群が炭水化物や蛋白質を分解して生成する短鎖脂肪酸(美容通信2024年1月号)は、前述のホルモン産生の制御に加え、上皮組織のバリア機能の制御や免疫細胞の分化を抑制する事で、腸管局所だけでなく、脳みそや肝臓を含め、多くの遠隔臓器の恒常性維持に関与しています。
腸粘膜組織から遠隔臓器への病態形成への影響(腸→遠隔臓器疾患)
 腸の微生物叢と粘膜免疫を含有する腸粘膜組織は、腸管局所的な役割だけでなく、全身性に作用する事で、生体の恒常維持に寄与します。しかしながら、その多岐に亘る生理学的に重要な役割故に、腸粘膜組織で起こる微生物叢/粘膜免疫の乱れが、ある種の免疫細胞や微生物(代謝物を含む)のバランスが崩れ、遠隔臓器の脈管系を介して移動する事で、様々な遠隔臓器での病態形成に影響を及ぼします。
腸の微生物叢と粘膜免疫を含有する腸粘膜組織は、腸管局所的な役割だけでなく、全身性に作用する事で、生体の恒常維持に寄与します。しかしながら、その多岐に亘る生理学的に重要な役割故に、腸粘膜組織で起こる微生物叢/粘膜免疫の乱れが、ある種の免疫細胞や微生物(代謝物を含む)のバランスが崩れ、遠隔臓器の脈管系を介して移動する事で、様々な遠隔臓器での病態形成に影響を及ぼします。
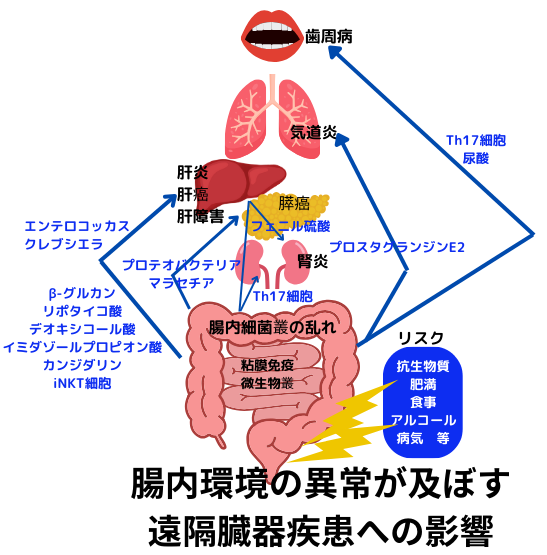
下記に腸内環境の異常が及ぼす遠隔臓器の病気への影響を列挙します。全てではないですが、以前特集した腸内細菌の便検査(美容通信2024年1月号)(美容通信2024年8月号)の詳細結果を見ながら読むと…実際の介入の方法とその重要性をひしひしと感じます。
[口腔で増悪する病気]
- 肥満:腸管では、肥満関連腸内細菌の増加(尿酸の増加)→尿酸を媒介→口腔に於ける炎症性骨破壊(歯周炎)
- 歯周炎:Porphyromonas gingivalisによる腸管Th17細胞の誘導→Th17細胞を媒介→口腔に於ける炎症増悪(歯周炎)
[肝臓で増悪する病気]
- 肥満
- 肥満関連腸内細菌の増加(デオキシコール酸の増加)→デオキシコール酸を媒介→肝臓の肝星細胞の老化と炎症(肝癌)
-
肥満関連腸内細菌の増加(リポタイコ酸の増加)→リポタイコ酸を媒介→肝臓の肝星細胞を介した抗腫瘍免疫の抑制(肝癌)
- アルコール
-
腸管上皮透過性の亢進(Enterococcus faecalis)→エンテロコッカスを媒介→肝臓のクッパー細胞由来IL1β(アルコール性肝障害)
-
腸管上皮透過性の亢進(真菌の構成物)→β‐グルカンを媒介→肝臓のクッパー細胞由来IL1β(アルコール性肝障害)
-
腸管上皮透過性の亢進(真菌のトキシン)→カンジダリシンを媒介→肝臓の肝細胞死の誘導(アルコール性肝障害)
- 腸管上皮細胞のCD1d誘導(iNKT細胞の誘導)→iNKT細胞を媒介→肝臓の肝細胞死の誘導(アルコール性肝障害)
-
- 不明:原発性硬化性胆管炎関連腸内細菌の増加(Klebsiella pneumoniae)→クレブシエラを媒介→肝臓でのTh17誘導と炎症(原発性硬化性胆管炎)
- 糖尿病:糖尿病関連腸内細菌の増加(イミダゾール・プロピオン酸の増加)→イミダゾールプロピオン酸を媒介→肝臓でのmTORC1を介したインスリンシグナルを阻害(糖尿病)
[膵臓で増悪する病気]
- 膵臓癌
- 膵癌関連腸内細菌(プロテオバクテリア等が増加)→プロテオバクテリアを媒介→膵臓での免疫抑制的環境の醸成(膵臓癌)
- 膵癌関連腸内細菌(マラセチア等が増加)→マラセチアを媒介→膵臓での補体C3aを介した腫瘍増殖(膵癌)
[肺で増悪する病気]
- 抗生物質
- 抗生物質による腸内細菌の乱れ(カンジダの増殖とプロスタグランジンE2の産生)→プロスタグランジンE2を媒介→肺組織でのマクロファージ誘導(アレルギー性気道炎症)
- 抗生物質による腸内細菌の乱れ(ワレミア真菌の増殖)→媒介物は不明→肺組織での気道炎症(喘息様気道炎症)
[腎臓で増悪する病気]
- 不明:腸内常在細菌(バンコマイシン感受性細菌がTh17細胞を誘導.詳細不明)→TH17細胞を媒介→腎臓に於ける炎症惹起(急速進行性糸球体腎炎)
- 食事由来チロシン:チロシンフェノールリアーゼ陽性腸内細菌(腸管フェノール増加→肝臓でのフェニル硫酸増加)→フェニル硫酸を媒介→腎臓に於けるミトコンドリア障害(糖尿病性腎臓病)
■腸粘膜から口腔疾患へ
 おデブが、歯周病になりやすく、しかも重症化しやすいのは昔から知られていますが、これは、どうも、デブちんの腸内微生物叢ではプリン代謝経路が亢進しており、その結果、血中の尿酸の上昇を介して歯周病の炎症性骨破壊が促進されているのではないかと考えられています。更には、腸内細菌叢の代謝産物だけでなく、歯周病関連口腔細菌であるPorphyromonaus gingivalisが腸管に到達すると、パイエル板のM細胞(美容通信2014年1月号)に取り込まれる事で、腸管にTh17細胞が誘導されます。更にそれらの腸管Th17細胞(美容通信2014年1月号)はCCR6ケモカインを発現する事で、歯周炎により口腔粘膜から産生されるCCL20ケモカインを介して口腔へ移動し、口腔炎症の増悪に火を注ぐんだそうな…。
おデブが、歯周病になりやすく、しかも重症化しやすいのは昔から知られていますが、これは、どうも、デブちんの腸内微生物叢ではプリン代謝経路が亢進しており、その結果、血中の尿酸の上昇を介して歯周病の炎症性骨破壊が促進されているのではないかと考えられています。更には、腸内細菌叢の代謝産物だけでなく、歯周病関連口腔細菌であるPorphyromonaus gingivalisが腸管に到達すると、パイエル板のM細胞(美容通信2014年1月号)に取り込まれる事で、腸管にTh17細胞が誘導されます。更にそれらの腸管Th17細胞(美容通信2014年1月号)はCCR6ケモカインを発現する事で、歯周炎により口腔粘膜から産生されるCCL20ケモカインを介して口腔へ移動し、口腔炎症の増悪に火を注ぐんだそうな…。
■腸粘膜から肝臓の病気へ
肥満が肝臓の病気の大いなるリスクである事は良く知られていますが、その一端を腸内細菌叢が担っています。例えば、肥満により増加した腸内細菌の代謝産物であるデオキシコール酸が、腸肝循環(美容通信2017年8月号)により肝臓に達し、肝臓の間質に存在する肝星細胞のDNAを損傷し、細胞老化を介した炎症性サイトカインの産生を促し、周囲の肝実質細胞の発癌を促進すると考えられています。更に、腸内細菌の代謝産物以外にも、グラム陽性細菌の細胞表層の主要構成成分の一つであるリポタイコ酸(LTA)も、同様の経路により肝臓の肝星細胞に作用し、プロスタグランジンE2の産生誘導を介した抗腫瘍免疫抑制により、肝癌の増悪に関与しています。
また、肝癌だけでなく、アルコール性肝障害に於いても、アルコールを慢性的に飲んでいると、腸管上皮の透過性が上がり、ある種の腸内微生物(例・Enterococcus faecalis, 真菌)や若しくはその構成分子(例・β‐グルカン)やトキシン(例・カンジダリン)が腸管から肝臓に移行します。クッパー細胞や肝細胞に作用し、炎症性サイトカインの産生や細胞死を誘導し、肝障害への地獄の引導と化してしまいます。更に微生物だけでなく、腸由来のiNKT細胞が肝臓に移行し、肝細胞の細胞死を引き起こし、肝障害を起こします。そして、原発性硬化性胆管炎の患者さんでは、腸管由来の細菌であるKlebsiella pneumoniaeが腸管上皮バリアを破綻させ、肝臓でのTh17細胞の誘導を介して、遠く離れた短観組織のの炎症を増悪させます。更には、2型糖尿病患者に於いて特徴的な腸内細菌群(例・Eggerthella lenta)が産生するイミダゾール・プロピオン酸(ヒスチジン代謝物)が、肝臓に於けるインスリン抵抗性に係るシグナルを誘導しています。
■腸粘膜から膵臓の病気へ
 膵臓癌の患者さんでは、ある種の腸内細菌が膵臓腫瘍に侵入する事で、ミエロイド系抑制性細胞や腫瘍随伴性マクロファージの誘導を介して免疫抑制的な膵腫瘍環境を作り出し、膵癌の増悪に関与する可能性があります。更に、細菌だけでなく、膵癌の患者さんでは、腸由来の真菌であるマラセチアが補体カスケードを活性化し、引いては膵癌細胞の増殖を誘導してしまうようです。
膵臓癌の患者さんでは、ある種の腸内細菌が膵臓腫瘍に侵入する事で、ミエロイド系抑制性細胞や腫瘍随伴性マクロファージの誘導を介して免疫抑制的な膵腫瘍環境を作り出し、膵癌の増悪に関与する可能性があります。更に、細菌だけでなく、膵癌の患者さんでは、腸由来の真菌であるマラセチアが補体カスケードを活性化し、引いては膵癌細胞の増殖を誘導してしまうようです。
■腸粘膜から呼吸器の病気へ
抗生物質の乱用により乱れてしまった腸内細菌叢は、遠く離れた呼吸器の炎症にも関与しています。例えば、ある種の抗生物質は、腸管内の真菌であるCandidaの増殖を引き起こします。その結果、Candidaが産生するプロスタグランジンE2が血流に乗り、遠く離れた肺組織に到達し、M2マクロファージの誘導を介したアレルギー性気道炎症の病態に関与します。また、詳細なメカニズムはまだ解明はされてはいませんが、抗生物質により一時的に乱れてしまった腸内細菌叢では、真菌の一種であるWallemia mellicolaが腸内で過剰に増殖し、ダニやハウスダスト等に対する気道炎症反応が増悪してしまいます。
■腸粘膜から腎臓の病気へ
自己免疫性腎疾患の一種である急速進行性糸球体腎炎では、ある種の腸内関連細菌が腸管のTh17細胞を誘導し、S1P受容体を介した腎臓への移行によって、腎臓の病気へと発展するとの報告があります。更には、腸内細菌のみが保有する酵素であるチロシンフェノールリアーゼにより、食事由来のチロシンがフェノールに代謝され、肝臓でフェニル硫酸に変換されます。フェニル硫酸の血中濃度の上昇は、腎臓のミトコンドリア機能の障害を介して、糖尿病性腎臓病の病態形成に寄与します。
遠隔臓器から腸の病態形成への影響(遠隔臓器→腸)
腸を起点とした臓器関連研究と比べると、まだまだ、研究が進んではいませんが、逆もまた真なり。近年、口腔領域に於ける病気が、ある種の口腔免疫細胞や口腔細菌等を介して、腸の恒常性の破綻及び病態形成に関わっている事が明らかになって来ました。
近年、肝臓や膵臓が、胆汁酸や細菌結合性糖蛋白質を産生し、腸内の制御性T細胞の誘導や腸管内の潜在的病原性細菌の捕捉を介して、腸管の恒常性の維持に貢献しています。口腔以外の他の臓器からの腸疾患への関与についても、今後研究が進むと思われます。
■口腔から腸粘膜の病気への関与
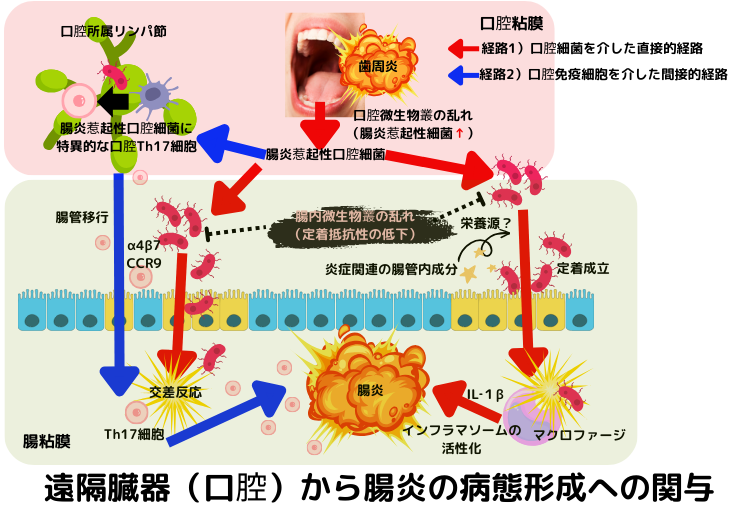
炎症性腸疾患は、潰瘍性大腸炎やクローン病に代表される、慢性炎症を特徴とする原因不明の難治性の腸の病気です。これらの炎症性腸疾患と口腔粘膜(微生物叢)との間に、免疫微生物学的な因果関係が存在する事が次第に明らかになって来ました。
上図を見て下さい。口腔炎症によって口腔微生物叢が乱れる事で、腸炎惹起性口腔細菌が増加します。これら病原性口腔細菌は、先立つ炎症等で腸内細菌叢が乱れる(腸管抵抗性が低下する)事で、腸管に定着し、腸炎を惹起します(経路1)口腔細菌による直接的な経路)。同時に、病原性口腔細菌は、口腔の所属リンパ節に於いてTh17細胞を誘導します。誘導された口腔Th17細胞は、腸管ホーミング分子を発現し、腸管移動後に口腔細菌性の抗原に出会う事で、増殖し、腸炎の増悪に関与します(経路2)口腔免疫細胞による間接的な経路)。
食事による腸管粘膜免疫の制御と代謝疾患
 Forbes JAPANは2023年09月27日に、糖尿病患者が血中のインスリン濃度を調節するのを助ける新しい方法を模索する、スイスのETH Zurich(スイス連邦工科大学チューリヒ校)のマルティン・フッセネガー教授(Prof. Martin Fussenegger at ETH Zurich)が率いる研究チームが、イギリスのロックバンド「クイーン(Queen)」の代表曲「We Will Rock You(ウィ・ウィル・ロック・ユー)」を流す事で、デザイン細胞からインスリンを分泌させる手法を開発したと報告した…。We Will Rock Youは、エイズには効果はないみたいですが、これで血糖値のコントロールが出来るんなら、ロック小僧になるのも悪くない、か(笑)。
Forbes JAPANは2023年09月27日に、糖尿病患者が血中のインスリン濃度を調節するのを助ける新しい方法を模索する、スイスのETH Zurich(スイス連邦工科大学チューリヒ校)のマルティン・フッセネガー教授(Prof. Martin Fussenegger at ETH Zurich)が率いる研究チームが、イギリスのロックバンド「クイーン(Queen)」の代表曲「We Will Rock You(ウィ・ウィル・ロック・ユー)」を流す事で、デザイン細胞からインスリンを分泌させる手法を開発したと報告した…。We Will Rock Youは、エイズには効果はないみたいですが、これで血糖値のコントロールが出来るんなら、ロック小僧になるのも悪くない、か(笑)。
肥満糖尿病の病態基盤であるインスリン抵抗性発症機序として、腸管粘膜免疫の役割が注目されています。通常の腸管粘膜には抗炎症の免疫細胞が豊富ですが、肥満状態ではそれらは炎症性に傾いてしまうんです。その元凶となる刺激として一番有名なのが高脂肪食とされていましたが、近年になって、高蔗糖が腸管免疫の恒常性を破綻させる可能性が示唆されています。
 因みに、蔗糖と砂糖は同じものです。”砂糖” という言葉は、一般的には粉状の蔗糖を指す際に使われますが、必ずしも粉状なければ砂糖に非ずなんて料簡が狭いものではありません(笑)。蔗糖は、さとうきびや甜菜等の植物から抽出され、精製されたもので、化学的には、グルコースとフルクトースという二つの単糖から構成される二糖です。食品産業で広く使用され、調味料やスウィーツ、ケーキ、クッキー、ジャム、ジュース、炭酸飲料等の多くの食品や飲料に添加されています。また、コーヒーや紅茶等の飲み物にも良く使われています。
因みに、蔗糖と砂糖は同じものです。”砂糖” という言葉は、一般的には粉状の蔗糖を指す際に使われますが、必ずしも粉状なければ砂糖に非ずなんて料簡が狭いものではありません(笑)。蔗糖は、さとうきびや甜菜等の植物から抽出され、精製されたもので、化学的には、グルコースとフルクトースという二つの単糖から構成される二糖です。食品産業で広く使用され、調味料やスウィーツ、ケーキ、クッキー、ジャム、ジュース、炭酸飲料等の多くの食品や飲料に添加されています。また、コーヒーや紅茶等の飲み物にも良く使われています。
音楽ではなく、食事による腸管免疫の制御で、代謝疾患の治療の可能性について、最新の知見を記載します。
腸管粘膜免疫は、腸内細菌叢と共生関係にあり、糖・エネルギー代謝の恒常性を維持する
私達の腸内には、100兆・1000種以上の腸内細菌が共生し、腸内細菌叢を形成しています。世が世ならば(笑)、腸内細菌と言えども、バイ菌はバイ菌でしかないのですから、拒絶されてしかるべき。しかしながら、長い歴史の中で共生と言う悪魔の取引?談合?を交わした為、宿主の私達は腸管免疫寛容と言う免罪符を与え、常在菌由来の抗原に反応しない様になりました。最近になって、食物や胆汁酸を原料とした腸内細菌の代謝産物が、腸管免疫寛容を維持し、全身の糖・エネルギー代謝を調節する事が分かって来ました。例えば、食物繊維のセルロースは、腸内細菌叢の作用で短鎖脂肪酸に代謝され、遊離脂肪酸受容体FFARを介し、免疫細胞を抗炎症性に制御し、G蛋白質共役型受容体GPR41を介し、腸管上皮細胞のバリア機能維持、ゴブレット細胞のムチン産生を促進し、腸内環境を維持します。胆汁酸は肝臓で作られ、腸内細菌叢によって一次胆汁酸から二次胆汁酸に代謝されます。各胆汁酸は、腸管免疫及び再吸収を経て、全身臓器に作用し、核ホルモン受容体farnesoid X receptorや細胞表面受容体TGR5の活性化を介し、腸管免疫細胞・上皮細胞に於ける炎症抑制、褐色脂肪細胞に於けるエネルギー消費増加、腸内分泌細胞に於けるGLP-1分泌促進等の、糖代謝改善作用が報告されています。
また、全ての腸内細菌種が腸管免疫細胞を直接的に誘導出来る訳ではないですが、限られた一部の腸内細菌種は、直接的に腸管免疫細胞の質や量を調節しているようです。報告によれば、segmented filamentous bacteria、human 20 strains、Bifidobacterium adolescentisは、恒常性細胞を誘導しますし、Clostridium clusters ⅩⅣ、Bacteroides fragilisは、Tregを誘導します。更には、近年になり、Helicobacter hepaticusがRORγt+TregとThf細胞を誘導し、アンチエイジング界の寵児Akkermansia muciniphlia(美容通信2024年1月号)がThf細胞を誘導するとの報告も。つまり、この連中を制御すれば、腸管免疫の質や量を調整し、引いては、肥満や糖尿病等の代謝疾患の治療に繋がるって事なんですね。
高脂肪食による腸内細菌叢の偏りは、代謝疾患リスクとなる
腸内細菌叢の組成が、食事や炎症、加齢等の刺激で変化する事は、腸内細菌叢の偏り(dysbiosis)として良く知られていますが、dysbiosisは病原性の腸内細菌が増加するだけでなく、その多様性を低下させてしまいます。腸内細菌叢の偏りを引き起こす食の刺激としては、高脂肪食が最も良く知られています。高脂肪食は、腸管バリアを破壊してしまうので、ここから腸内細菌由来の内毒素が血液内に漏れ出し(エンドトキシン血症)、脂肪組織の慢性炎症を誘発し。全身のインスリン抵抗性を引き起こしてしまいます。この様なmatabolic endotoxemiaの状態は、肥満糖尿病等の代謝疾患が発症する前から生じて(美容通信2024年3月号)おり、その予防には、腸内環境を整える事が非常に重要と考えられています。
高脂肪食による腸管炎症が、メタボリックシンドロームの1st STEP
メタボリックシンドロームの1st STEPは、高脂肪食による脂肪の慢性炎症と長らく考えられていましたが、脂肪よりも前に、高脂肪食による腸管の炎症が起こっており、これが真の1st STEPと判明! それに伴い、今では、腸管粘膜免疫細胞が、メタボリックシンドロームの新しい治療標的として認識されるようになって来ました。
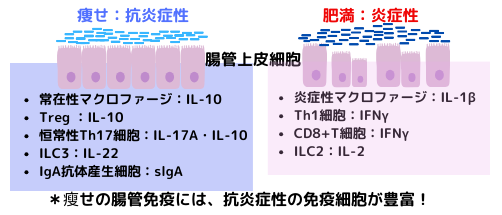 痩せ状態では、右図の如く、腸管にはTreg、恒常性Th17細胞、ILC3と言った抗炎症性の免疫細胞が多く分布しているのに対し、肥満状態では、腸管にはTh1細胞、CD8+T細胞、炎症性マクロファージ等の炎症性の免疫細胞が多く存在する事が分かっています。
痩せ状態では、右図の如く、腸管にはTreg、恒常性Th17細胞、ILC3と言った抗炎症性の免疫細胞が多く分布しているのに対し、肥満状態では、腸管にはTh1細胞、CD8+T細胞、炎症性マクロファージ等の炎症性の免疫細胞が多く存在する事が分かっています。
しかしながら、通常状態に於ける腸管の粘膜免疫細胞のうちの、一体どこのどいつが肥満関連腸炎を抑制するキーマンなのかは、未だ、解明されていません( ;∀;)。
腸管粘膜の免疫細胞が、腸管上皮に於ける脂肪の吸収能を調節する
腸管粘膜の免疫細胞が、全身の糖・エネルギー代謝を制御するメカニズムとしては、肥満関連腸炎の他に、腸管上皮に於ける脂肪の吸収能の調節が挙げられます。しかしながら、未だ、肥満糖尿病の治療標的となり得る、脂肪吸収を抑制する具体的な腸内細菌の種類までは分かっていません。
小腸に常在する抗炎症性Th17細胞に、抗肥満・抗糖尿病効果がある!!
常在細菌叢の一種であるsegmented filamentous bacteriaは、Th17細胞(SFB-Th17細胞)を誘導します。Th17細胞は、感染症や炎症性腸疾患の領域に於いて炎症性の側面が良く知られていますが、実は、segmented filamentous bacteriaが誘導する小腸に常在するTh17細胞は、抗炎症性として働きます。真逆です。つまり、炎症性に働くか非炎症性に働くかは、誘導細菌や部位によって異なり、Th17細胞由来のIL-17AやIL-10は、腸管バリア機能を強化します。まあ、同じ人間も、見方によっては、善人にも悪人にもなる。それと同じですよね。群盲象を評す、か(笑)。
以下は動物(マウス)実験のレベルではありますが、segmented filamentous bacteriaが誘導する小腸に常在するTh17細胞には、抗肥満・抗糖尿病効果があり、更に興味深い事には、高脂肪食下でも、segmented filamentous bacteriaが誘導する小腸に常在するTh17細胞が維持されているマウスでは、肥満関連腸炎も脂肪の吸収能も抑制されているんだそうです。
高蔗糖食下では、小腸の抗炎症性Th17細胞の維持機構が破綻する…
segmented filamentous bacteriaが誘導する小腸に常在するTh17細胞は、抗炎症性に働いてくれますが、高蔗糖下では、腸管への定着が阻害されてしまい、数が減少してしまいます。動物実験でも、高脂肪食であっても、スクロースを排除した餌を与えたマウスは、Th17細胞が維持され、脂肪の吸収も肥満関連腸炎も抑制され、肥満糖尿病を発症しなかったそうです。
フルクトースの過剰摂取は、腸管の代謝限界を超え、腸内環境の恒常性を破綻させる
糖尿病の治療に於いて、食事療法は治療の根幹とされていますが、その根本的な治療方法は未だに解明されていません。しかしながら、従来のエビデンスから予後改善が期待される食事、例えば、低炭水化物食(ロカボ)、和食、地中海食、パレオダイエット、サウスビーチダイエット等が挙げられますが、これ等の共通点は全て低フルクトース食なんです。
従来、下図の様に、スクロースは、グルコースとフルクトースに分解された後、フルクトースは小腸から肝臓に直接流入して、脂肪肝を誘導すると言う古典的な代謝経路が知られていました。
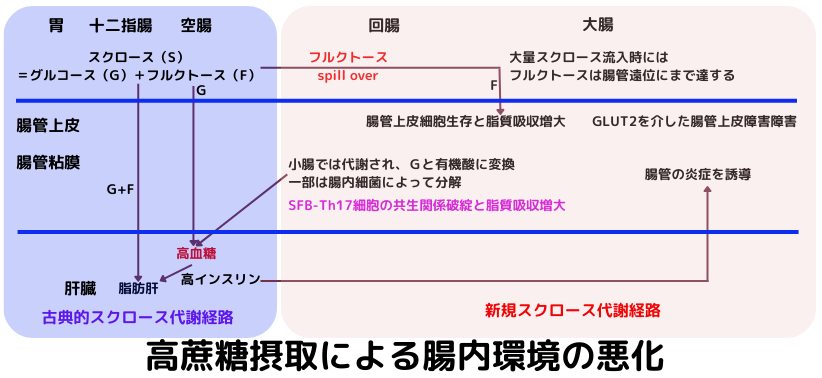 しかし、近年になって、高濃度の蔗糖が腸管内に流入した時は、フルクトースが代謝しきれずに、腸管下部まで流入し、腸管上皮細胞生存や脂質吸収増大を引き起こしたり、小腸で代謝され、グルコースと有機酸に変換され、一部は腸内細菌によって分解される事が分かって来ました。フルクトースは、少なくとも、in vivoレベルでは、炎症性にシフトさせる事が分かっています。
しかし、近年になって、高濃度の蔗糖が腸管内に流入した時は、フルクトースが代謝しきれずに、腸管下部まで流入し、腸管上皮細胞生存や脂質吸収増大を引き起こしたり、小腸で代謝され、グルコースと有機酸に変換され、一部は腸内細菌によって分解される事が分かって来ました。フルクトースは、少なくとも、in vivoレベルでは、炎症性にシフトさせる事が分かっています。
食物繊維と発酵食品による代謝疾患のコントロール
腸内細菌叢の偏り(dysbiosis)による腸内細菌の多様性の低下は、肥満や糖尿病と言った多くの非感染性疾患の増加と関連しています。腸内細菌の多様性の低下を改善させる食事として有名なものが、食物繊維と発酵食品です。最近の研究で、私達人間に於いても、食物繊維と発酵食品が齎す腸内細菌や炎症への効果が検討され、腸内環境の多様性については、両者で改善が認められたそうです。炎症マーカーに関しては、発酵食品が有意に低下させたそうです。つまり、高脂肪食や高蔗糖食によって惹起されてしまった、腸内細菌の多様性の低下、腸管免疫の炎症性変化を、食物繊維や発酵食品は回復させる可能性が指摘されています。
HISAKOのクリニックでは、便検査を行い、有用だけど、お腹に不足している腸内細菌を調べ、その腸内細菌達が増えるように、大好きな餌を提案しています。と言っても、KIRINが、便検査の結果から4種類の製品からおススメを提案してくれるのを、売ってるだけなんですけどね(美容通信2024年1月号)(美容通信2024年8月号)。
*註:HISAKOの美容通信に記載されている料金(消費税率等を含む)・施術内容等は、あくまでも発行日時点のものです。従って、諸事情により、料金(消費税率等を含む)・施術内容等が変更になっている場合があります。予め、御確認下さい。
*治療の内容によっては、国内未承認医薬品または医療機器を用いて施術を行います。治療に用いる医薬品および機器は当院医師の判断の元、個人輸入手続きを行ったものです。
関連ページ
関連するHISAKOの美容通信をピックアップしました。
-
- 便検査を踏まえた効率の良い腸活
- 生物学的年齢と暦年齢
- シン・マクロファージ
- 大豆麹乳酸菌発酵液バイオジェニックス
- 食事中のAGEsは有害?無害?
- 病気の発症と腸内細菌
- アルベックス
- 酵母菌と遅延性フードアレルギー
- 遅延性フードアレルギー
- 皮膚微生物叢
来月号の予告
まつ毛美容液です。
スタッフ全員、推してます(笑)。
<LASHOULD>