HISAKOの美容通信2028年3月号
鉄毒性が引き起こす新たな細胞死|フェロトーシス
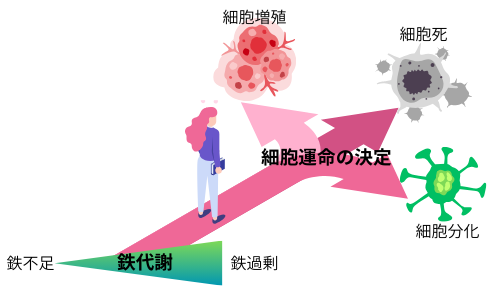
 鉄は生命活動に必須の微量元素であり、細胞内で多くの酵素反応を調節します。近年、鉄毒性が引き起こす新たな細胞死のメカニズムとして「フェロトーシス」が発見され、鉄代謝、脂質代謝、レドックス制御のバランスが崩れる事により、細胞障害が引き起こされる事が明らかになりました。このメカニズムは、癌や老化、組織障害等の理解に新たな視点を齎し、その予防法や治療法の開発への応用が期待されています。
鉄は生命活動に必須の微量元素であり、細胞内で多くの酵素反応を調節します。近年、鉄毒性が引き起こす新たな細胞死のメカニズムとして「フェロトーシス」が発見され、鉄代謝、脂質代謝、レドックス制御のバランスが崩れる事により、細胞障害が引き起こされる事が明らかになりました。このメカニズムは、癌や老化、組織障害等の理解に新たな視点を齎し、その予防法や治療法の開発への応用が期待されています。
鉄と過酸化脂質の関係は昔から知られてはいましたが、Brent StockwellとScott J. Dixonがフェロトーシスという言葉を作り、その主要な特徴のいくつかを説明したのは2012年になってから。とても新しい細胞死の概念です。
新たな細胞死のメカニズム「フェロトーシス」
鉄の光と影
■鉄は生命活動に必須の微量金属元素
私達の体にある鉄の量は、鉄釘1本分(約5g)とされています。鉄は、赤血球に於いてヘモグロビン活性中心として酸素運搬に必須の役割を担う等、様々な生命活動に欠かせない機能を果たす微量金属元素です。近年、鉄が関与する新たな細胞死の概念として、フェロトーシスが知られるようになって来ました。
 鉄は、地球上に重力比で最も多く存在する元素であり、生命はその起源から鉄を利用して代謝活動を行い、生命を維持して来ました。現存するあらゆる生命体の共通の祖先であるLUCA(the last universal common ancestor)は、地球上に酸素が存在しない時代に、鉄を利用して嫌気的代謝を行い、その生命を維持していたと考えられています。この様に、鉄は電子を容易に授受し易い化学的性質から、多くの酵素反応の足場となり、殆どの生物、及び殆どの細胞にとって、広範な生命機能に必須の役割を担います。私達人間に於いては、約400種類の鉄結合蛋白質が存在しているとされており、鉄はゲノム精製やエピジェネティクスを介した転写調節、電子伝達系等の広範な細胞機能に係る酵素の補因子として生命活動に欠かせない元素です。
鉄は、地球上に重力比で最も多く存在する元素であり、生命はその起源から鉄を利用して代謝活動を行い、生命を維持して来ました。現存するあらゆる生命体の共通の祖先であるLUCA(the last universal common ancestor)は、地球上に酸素が存在しない時代に、鉄を利用して嫌気的代謝を行い、その生命を維持していたと考えられています。この様に、鉄は電子を容易に授受し易い化学的性質から、多くの酵素反応の足場となり、殆どの生物、及び殆どの細胞にとって、広範な生命機能に必須の役割を担います。私達人間に於いては、約400種類の鉄結合蛋白質が存在しているとされており、鉄はゲノム精製やエピジェネティクスを介した転写調節、電子伝達系等の広範な細胞機能に係る酵素の補因子として生命活動に欠かせない元素です。
 また、近年、これ等の鉄結合蛋白質の鉄に対する親和性は、ものによって大きく異なる事が知られるようになりました。例えば、同じヒストン脱メチル化酵素であるKDM3AとKDM3Bは、共に鉄をその酵素活性に必要としますが、両者の鉄の親和性は40倍も異なり、鉄への親和性が低いKDM3Bが介在するH3K9me2の脱メチル化反応は、細胞が鉄欠乏に陥ると、その活性は大きく低下してしまいます。即ち、鉄は酵素反応に必須であるのみならず、その活性を動的に制御し得る因子としても再注目されています。
また、近年、これ等の鉄結合蛋白質の鉄に対する親和性は、ものによって大きく異なる事が知られるようになりました。例えば、同じヒストン脱メチル化酵素であるKDM3AとKDM3Bは、共に鉄をその酵素活性に必要としますが、両者の鉄の親和性は40倍も異なり、鉄への親和性が低いKDM3Bが介在するH3K9me2の脱メチル化反応は、細胞が鉄欠乏に陥ると、その活性は大きく低下してしまいます。即ち、鉄は酵素反応に必須であるのみならず、その活性を動的に制御し得る因子としても再注目されています。
■鉄が関与する新たな細胞死の概念:フェロトーシス
この様に、鉄は生命活動に必須の役割を担う一方で、過剰な細胞内の遊離鉄は、フェントン反応(美容通信2021年4月号)Fe2++H2O2→Fe3++OH–+OH–を介して、酸化障害を引き起こす等、細胞毒性を有しています。例えば、全身に鉄が蓄積するヘモクロマトーシスでは、鉄の蓄積による組織傷害から、肝障害、糖尿病、心筋症等の臓器障害を来します。これまで鉄による細胞損傷の分子基盤については明確ではありませんでしたが、2012年に細胞内の鉄過剰による脂質の過酸化が惹起する新しい細胞死の概念として、フェロトーシスが発見されました。フェロトーシスは、癌や神経変性疾患、虚血再灌流障害等の病態に深く関与する事が示唆されています。
フェロトーシスとは
フェロトーシスは、①鉄代謝、②脂質代謝、③レドックス制御のバランスの不均衡が齎す細胞死であり、様々な病態との関連が注目されています。
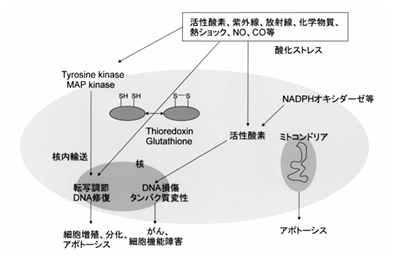 用語の補足を先にしますが、レドックスとは還元(reduction)と酸化(oxidation)の合成語です。レドックス制御とは、生体の酸化還元状態を制御する事によって、多くの外来性の因子、例えば、薬剤、放射線、紫外線、環境物質である農薬、ダイオキシン等、また、高熱、低温、低酸素状態等の多彩なストレスに適応し、ホメオスタシスを維持するシステムです。細胞外から細胞内へのシグナル伝達に於いて、その伝達に関わる分子は、レドックス制御を受けている事が明らかになっています。
用語の補足を先にしますが、レドックスとは還元(reduction)と酸化(oxidation)の合成語です。レドックス制御とは、生体の酸化還元状態を制御する事によって、多くの外来性の因子、例えば、薬剤、放射線、紫外線、環境物質である農薬、ダイオキシン等、また、高熱、低温、低酸素状態等の多彩なストレスに適応し、ホメオスタシスを維持するシステムです。細胞外から細胞内へのシグナル伝達に於いて、その伝達に関わる分子は、レドックス制御を受けている事が明らかになっています。
鉄はトランスフェリンと結合して3価(Fe3+)の状態で細胞内に運ばれ、2価(Fe2+)に還元されて、遊離鉄と言う反応性に富んだ鉄のプールを形成します。遊離鉄はミトコンドリアへと運ばれ、鉄硫黄クラスターやヘム等の鉄補欠分子族へと代謝され、様々な酵素の補因子として働く事により、細胞活動に必須の役割を担っています。
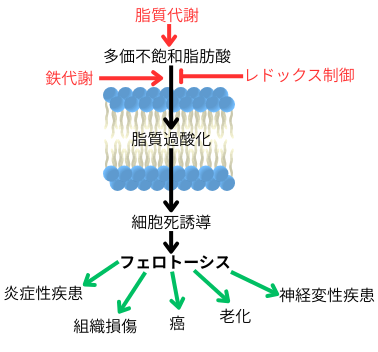 一方、過剰な遊離鉄は鉄毒性を示す為、細胞内の鉄代謝は厳密に調節されています。しかし、細胞内鉄動態の破綻により、遊離鉄が増加すると、フェントン反応を介して脂質過酸化が引き起こされます。この細胞膜での過酸化脂質の蓄積に伴い、細胞が膨張し、細胞膜の張力が増加する事で、機械刺激受容体を介した著しいカチオン流出入が起こり、フェロトーシスが誘発されます。この脂質過酸化は、細胞膜リン脂質中の脂肪酸組成に大きく影響される事が知られています。多価不飽和脂肪酸はラジカルにより容易に酸化され、連鎖的脂質過酸化反応の起点となりますが、一価不飽和脂肪酸はラジカルによる障害を受け難いと言う特徴があります。つまり、多価不飽和脂肪酸の増加は細胞のフェロトーシス感受性を高め、一価不飽和脂肪酸の蓄積はフェロトーシス耐性を齎します。つまり、フェロトーシスの誘因となる脂質過酸化は、この様に遊離鉄や多価不飽和脂肪酸で促進されますが、細胞のレドックス制御は過酸化脂質を除去し、フェロトーシスの抑制に働きます。
一方、過剰な遊離鉄は鉄毒性を示す為、細胞内の鉄代謝は厳密に調節されています。しかし、細胞内鉄動態の破綻により、遊離鉄が増加すると、フェントン反応を介して脂質過酸化が引き起こされます。この細胞膜での過酸化脂質の蓄積に伴い、細胞が膨張し、細胞膜の張力が増加する事で、機械刺激受容体を介した著しいカチオン流出入が起こり、フェロトーシスが誘発されます。この脂質過酸化は、細胞膜リン脂質中の脂肪酸組成に大きく影響される事が知られています。多価不飽和脂肪酸はラジカルにより容易に酸化され、連鎖的脂質過酸化反応の起点となりますが、一価不飽和脂肪酸はラジカルによる障害を受け難いと言う特徴があります。つまり、多価不飽和脂肪酸の増加は細胞のフェロトーシス感受性を高め、一価不飽和脂肪酸の蓄積はフェロトーシス耐性を齎します。つまり、フェロトーシスの誘因となる脂質過酸化は、この様に遊離鉄や多価不飽和脂肪酸で促進されますが、細胞のレドックス制御は過酸化脂質を除去し、フェロトーシスの抑制に働きます。
鉄毒性とフェロトーシス
生体内での鉄の形態
繰り返しになりますが、生体内では、鉄は、二価鉄(Fe2+)と三価鉄(Fe3+)の形態で存在します。細胞内は還元環境である為に主にFe2+として存在し、ミトコンドリア(美容通信2017年7月号)で、ヘム、鉄硫黄クラスター等の鉄補欠分子族に組み込まれた後、蛋白質と結合して酵素の補因子として利用されます。しかし、Fe2+は、容易にフェントン反応を介してFe3+に酸化され、電子を放出する事でROS(美容通信2017年10月号)を生成して生体分子を損傷します(←毒性が高い!)。これを防ぐ為に、過剰な鉄は、低毒性のFe3+として、貯蔵蛋白質であるフェリチンに格納されます。細胞への鉄取込みはトランスフェリン(transferrin:Tf)を介して行われ、血漿中の鉄は主にFe3+(Tr-Fe3+)として存在しています。
この様に、鉄は細胞内で利用される際にはFe2+として、運搬や貯蔵時にはFe3+へ変換される事で、安全に管理されています。
鉄代謝と鉄毒性抑制機構
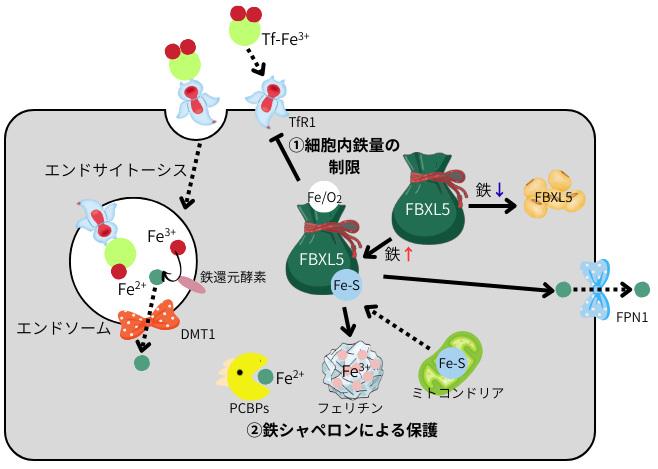 左図を見て下さい。多くの細胞では、トランスフェリン受容体(TfR1)がTf-Fe3+を認識し、エンドサイトーシスを介して鉄を取り込みます。エンドソーム内の酸性化により、Fe3+が遊離し、還元酵素によってFe2+へ変換された後、二価金属輸送体1(DMT1)を介して、細胞質へ輸送され、オルガネラに分配されます。細胞は、①細胞内の鉄量の制御、②遊離Fe2+の隔離と無毒化を通じて、鉄毒性から自身を保護します。
左図を見て下さい。多くの細胞では、トランスフェリン受容体(TfR1)がTf-Fe3+を認識し、エンドサイトーシスを介して鉄を取り込みます。エンドソーム内の酸性化により、Fe3+が遊離し、還元酵素によってFe2+へ変換された後、二価金属輸送体1(DMT1)を介して、細胞質へ輸送され、オルガネラに分配されます。細胞は、①細胞内の鉄量の制御、②遊離Fe2+の隔離と無毒化を通じて、鉄毒性から自身を保護します。
■鉄センサーによる鉄代謝抑制
細胞内の鉄濃度は、取込み・貯蔵・排出によって維持されています。鉄代謝関連蛋白質の発現は、iron responsive element(IRE)-iron regulatory protein(IRP)により調節されています。鉄が豊富な場合は、IRP2は分解され、その結果、TfR1の発現減少、フェリチン産生増加、鉄排出輸送体FPN1を介した鉄排泄が促進し、細胞内の鉄の増加が抑制されます。一方、鉄が枯渇すると、FBXL5の不安定化、IRP2の安定化により、細胞内鉄を増加させます。この鉄依存的な発現抑制は、FBXL5の鉄感知によって担われています。FBXL5には、Fe-O-Fe中心と2Fe-2S型の鉄硫黄クラスターが存在し、Fe2+の量に加え、ミトコンドリアでの鉄補欠分子族の生成を感知して細胞の鉄代謝を調節する鉄センサー分子であり、IRP2の発現抑制を介して、細胞内鉄濃度を一定に保ちます。
■鉄シャペロン分子による細胞質鉄の毒性低減
細胞質内は、グルタチオン(美容通信2018年7月号)等の低分子還元剤が豊富に存在し、還元状態に維持されているので、鉄は細胞質ではFe2+として0.5~5μM程度存在しています。しかし、Fe2+が単独で存在すると、ROSの産生を引き起こして、細胞にとって悪でしかありません。とっても危険な存在です。高濃度のGSHは、生理的pHに於いてFe2+‐グルタチオン複合体(Fe2+‐GSH)を形成し、Fe2+の反応性を抑制します。更には、この複合体は、鉄シャペロンPCBP1/2と結合する事で、より安全にFe2+のままで保持する事が可能になります。PCBPsは細胞内に5μM程度に発現しており、Fe2+の90%以上が、細胞内でPCBPsに結合した状態で存在していると考えられています。
この様に、低分子や鉄シャペロンの存在は、Fe2+の過剰な酸化還元反応を防ぎ、鉄毒性を軽減する重要な役割があります。
鉄毒性によるフェロトーシス惹起機序
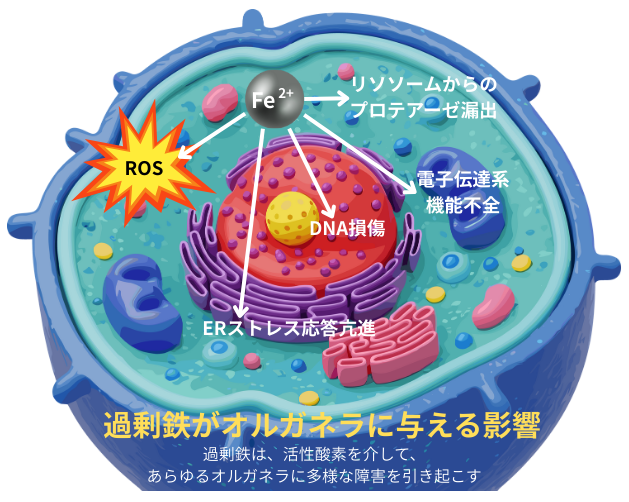 細胞内の鉄代謝は厳密に制御されていますが、このバランスが崩れると、過剰鉄によるフェロトーシスが起こります。
細胞内の鉄代謝は厳密に制御されていますが、このバランスが崩れると、過剰鉄によるフェロトーシスが起こります。
■ミトコンドリアと鉄過剰
ミトコンドリアは、鉄硫黄クラスターやヘムの合成に関与し、細胞のエネルギー代謝の中心的な役割を担っています。FBXL5は、鉄硫黄クラスター産生も感知します。ですから、ミトコンドリアの同クラスター産生障害では、ミトコンドリアへの鉄蓄積を特徴とする疾患を発症します。鉄過剰状態ではROS産生が亢進し、ミトコンドリアDNA損傷や電子伝達系の異常を介して、フェロトーシスが誘導されます。
■細胞質と鉄過剰
細胞質内の鉄はフェリチンに貯蔵され、鉄シャペロンにより遊離Fe2+濃度が調節されます。肝細胞特異的に鉄シャペロンPCBP1を欠損させたマウスでは、生理的な鉄濃度でも、遊離Fe2+が増加し、鉄毒性により脂肪肝を発症してしまいます。また、フェリチンをそもそも有していない酵母では、細胞質内の過剰鉄を液胞(←哺乳類ではリソソームに相当)内へ積極的に隔離する事で、鉄毒性を回避しています。細胞質内の遊離Fe2+の増加は、フェロトーシス誘導の重要な因子です。
■エンドソーム・リソソームと鉄過剰
 エンドソームやリソソームは、トランスフェリンTf経由で取り込まれた鉄が最初に到達するオルガネラです。フェリチンに貯蔵された鉄は、リソソームで分解されてリサイクルされます。その為、エンドソーム・リソソームの膜の透過性が増加すると、プロテアーゼの漏出が引き起こされ、細胞死が誘導されてしまいます。
エンドソームやリソソームは、トランスフェリンTf経由で取り込まれた鉄が最初に到達するオルガネラです。フェリチンに貯蔵された鉄は、リソソームで分解されてリサイクルされます。その為、エンドソーム・リソソームの膜の透過性が増加すると、プロテアーゼの漏出が引き起こされ、細胞死が誘導されてしまいます。
■核と鉄過剰
核内に於ける鉄蓄積は、DNA損傷やエピジェネティック制御(美容通信2027年10月号)の異常を引き起こします。過剰鉄は、DNAメチルトランスフェラーゼの活性阻害によるゲノムDNAの低メチル化や、ヒストンのメチル化修飾異常(美容通信2022年7月号)を介して、腫瘍形成の促進や細胞代謝の変化を齎します。
■小胞体・ゴルジ体と鉄過剰
過剰鉄は、小胞体ストレス応答を活性化し、フェロトーシスを促進します。しかし、小胞体・ゴルジ体への鉄輸送の詳細な制御機構や、その生理的意義については、未だ未解明です。
■ペルオキシソームと鉄過剰
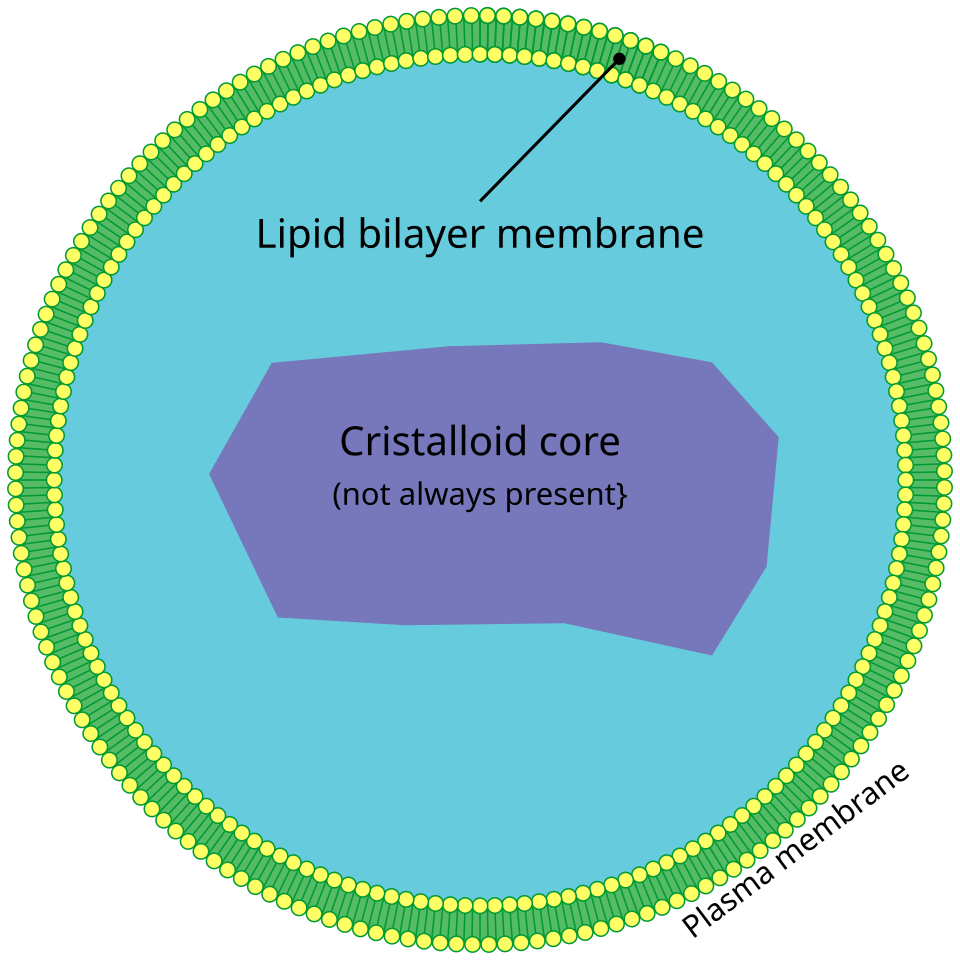 右図は、Wikipediaから拝借したペルオキシソームの基本的構造です。ペルオキシソームは、酸化反応を行う細胞小器官で、脂質代謝や活性酸素種の還元に重要な役割を果たしています。ペルオキシソームに於ける鉄毒性の直接的影響は明確ではありませんが、ペルオキシソームを出発点として合成されるリン脂質の一種であるプラズマローゲンが、フェロトーシス基質となる多価不飽和脂肪酸の貯蔵庫として機能する事から、鉄貯蔵が、ペルオキシソーム機能障害を介して、フェロトーシスに関与するのではないかと考えられています。
右図は、Wikipediaから拝借したペルオキシソームの基本的構造です。ペルオキシソームは、酸化反応を行う細胞小器官で、脂質代謝や活性酸素種の還元に重要な役割を果たしています。ペルオキシソームに於ける鉄毒性の直接的影響は明確ではありませんが、ペルオキシソームを出発点として合成されるリン脂質の一種であるプラズマローゲンが、フェロトーシス基質となる多価不飽和脂肪酸の貯蔵庫として機能する事から、鉄貯蔵が、ペルオキシソーム機能障害を介して、フェロトーシスに関与するのではないかと考えられています。
鉄毒性が関与する疾患
鉄毒性による細胞障害は、多岐な疾患の発症や進行に関与します。
■肝疾患
肝臓は体内の鉄の主要な貯蔵臓器であり、鉄代謝の恒常維持に中心的な役割を果たします。鉄過剰症や慢性肝疾患(例・アルコール性肝疾患、非アルコール性肝炎、ウイルス性肝炎)に於いて、鉄が過剰に蓄積すると、酸化ストレスを介して、肝細胞障害を引き起こします。また、過剰鉄は肝星細胞を活性化し、線維化を促進する事で、肝硬変や肝細胞癌のリスクを高めます。
■癌発症に於ける鉄毒性の意義
癌は遺伝子変異によって発症する疾患であり、鉄の過剰蓄積が発癌リスクを増加させます。特に、過剰鉄により生じたROSが、グアニン残基を8-hydroxy-2′-deoxyguanosineに酸化させる事で、遺伝子変異を誘発し、発癌リスクを高めます。また、癌抑制遺伝子TP53の変異やCDKN2Aのゲノム欠損を誘導し、細胞周期抑制の破綻を引き起こす事で癌発症に寄与します。
■神経性変性疾患に於ける鉄毒性の意義
フリードリッヒ運動失調症は遺伝性神経変性疾患の一つであり、フラタキシンの発現低下を特徴とします。フラタキシンは、ミトコンドリア内で鉄シャペロンとして機能し、鉄硫黄クラスターの合成に関与します。本疾患では、鉄硫黄クラスター依存性のミトコンドリア呼吸鎖複合体及びアコニターゼ(クエン酸回路の構成酵素)の活性低下に加え、FBXL5依存的な鉄恒常性の破綻により、ミトコンドリア内に鉄が蓄積し、細胞毒性が生じます。
アルツハイマー病の患者脳では大脳皮質、パーキンソン病では黒質に於いて鉄の蓄積が顕著であり、鉄過剰と病態進行の関連が示唆されています。
■虚血再灌流障害に於ける鉄毒性の意義
虚血とは、動脈閉塞や出血により、組織への血流が低下する病態であり、血流が再開する際に生じる酸化ストレスによって、更なる組織損傷が引き起こされます。この現象は虚血再灌流障害と呼ばれ、心筋梗塞、脳卒中、臓器移植等で問題となります。低酸素環境では、低酸素応答因子が活性化し、TfR1の発現を増加させる事で鉄の取込みが亢進します。再灌流による酸素分圧の上昇は、急激なROS産生を誘発し、組織を傷害します。
■鉄毒性による新型コロナウィルス感染症(COVID-19)の重症化
COVID-19の重症化メカニズムには、鉄代謝異常が関与する可能性が指摘されています。肺に於けるフェリチンやTfR1の発現が増加し、鉄蓄積が観察され、鉄毒性が感染全増悪因子として作用したと考えられています。
フェロトーシス感受性と細胞の脂質代謝
フェロトーシスとは、細胞膜の多価不飽和脂肪酸含リン脂質が過酸化され、蓄積する事によって引き起こされる、鉄依存性の細胞死の機序です。酸化脂質の異常蓄積により、細胞膜が損傷し、非アポトーシス性の細胞死が誘導されます。
膜リン脂質の多価不飽和脂肪酸代謝とフェロトーシス感受性
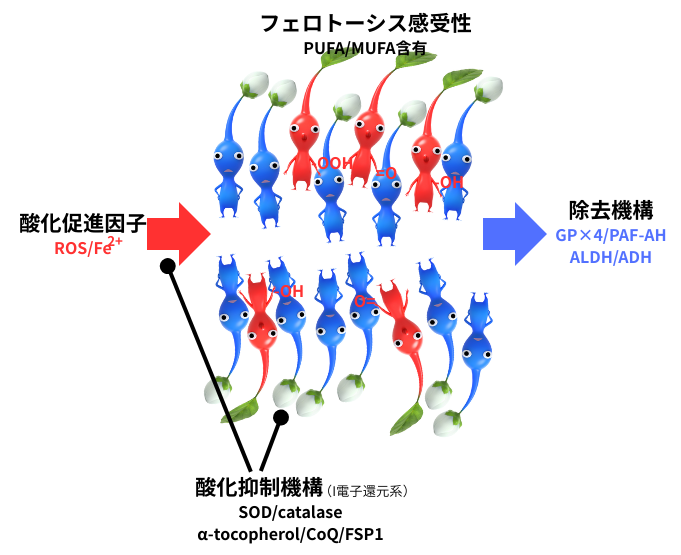 左図は、フェロトーシスを促進/抑制する要素を図示したものです。膜脂質の酸化反応は恒常的に起こるもので、通常は複数のメカニズムにより酸化脂質の蓄積が生じない様に保護されています。これに対して、フェロトーシスは、①ROS(活性酸素種)/Fe2+を中心とした酸化促進因子とその抑制機構、②感受性を決定する膜脂質中の脂肪酸組成、③生じた酸化物質の除去機構のバランスの破綻が、引き金となって起こります。
左図は、フェロトーシスを促進/抑制する要素を図示したものです。膜脂質の酸化反応は恒常的に起こるもので、通常は複数のメカニズムにより酸化脂質の蓄積が生じない様に保護されています。これに対して、フェロトーシスは、①ROS(活性酸素種)/Fe2+を中心とした酸化促進因子とその抑制機構、②感受性を決定する膜脂質中の脂肪酸組成、③生じた酸化物質の除去機構のバランスの破綻が、引き金となって起こります。
このうち、特に酸化促進因子(ROSやFe2+)に対するフェロトーシス感受性は、細胞膜リン脂質中の脂肪酸組成に大きく影響されます。
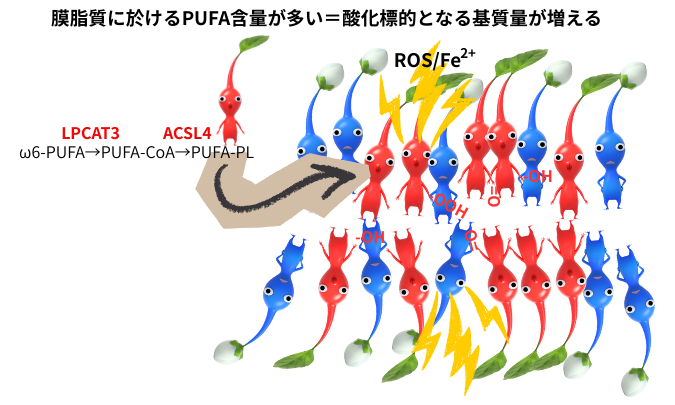 右図は、PUFA(多価不飽和脂肪酸)含量がフェロトーシス感受性を規定する事を図示したものです。ROSにより、PUFAは容易に酸化・ラジカル化され、連鎖的脂質過酸化反応の起点となります。ACSL4は、アラキドン酸等のオメガ6系多価不飽和脂肪酸(美容通信2010年6月号)を選択的にアシルCoAに変換する酵素で、LPCAT3は脂肪酸結合CoAを小胞体でリン脂質に再エステル化する酵素です。これらのPUFAに選択性のある膜脂質リンモデリング酵素の活性が亢進すると、細胞膜に含まれるPUFA含有リン脂質の量が増え、過酸化の基質となる脂質量が増え、フェロトーシス感受性が高まります。実際、ACSL4やLPCAT3を阻害又は失活させると、PUFA含有リン酸の過酸化が抑制され、脂質過酸化物の蓄積が低減し、細胞がフェロトーシスから保護されます。
右図は、PUFA(多価不飽和脂肪酸)含量がフェロトーシス感受性を規定する事を図示したものです。ROSにより、PUFAは容易に酸化・ラジカル化され、連鎖的脂質過酸化反応の起点となります。ACSL4は、アラキドン酸等のオメガ6系多価不飽和脂肪酸(美容通信2010年6月号)を選択的にアシルCoAに変換する酵素で、LPCAT3は脂肪酸結合CoAを小胞体でリン脂質に再エステル化する酵素です。これらのPUFAに選択性のある膜脂質リンモデリング酵素の活性が亢進すると、細胞膜に含まれるPUFA含有リン脂質の量が増え、過酸化の基質となる脂質量が増え、フェロトーシス感受性が高まります。実際、ACSL4やLPCAT3を阻害又は失活させると、PUFA含有リン酸の過酸化が抑制され、脂質過酸化物の蓄積が低減し、細胞がフェロトーシスから保護されます。
脂肪滴中のPUFAバッファリングと酸化
 細胞は、過剰なPUFAによる膜障害を回避する為にDGAT1/2の作用によって、PUFAをトリアシルグリセロール(TAG)に組み込んで、脂肪滴に貯蔵する事で膜から隔離し、過酸化感受性を低下させています。因みに、脂肪滴を表す言葉として、lipid droplet, lipid body, oil body, adiposome等が使われていますが、英語を母国語とする人にとってはdropletという単語は細胞の中にボテッと置かれた脂肪の塊という印象を与えるらしく…、HISAKOも、モーパッサンの脂肪の塊ではありませんが、学生時代はスライドの中に無為にぼてっと鎮座しているだけの存在としての認識しかありませんでした。その為、bodyという動きを感じさせる言葉の使用を主張する研究者もいるそうです。あ゛~っ、血のソーセージが、無性に食べたくなってしまった…。HISAKOは食べた事が無いですが、日本でも、戦前、栃木県の田舎では「それそれ」と呼ばれる血腸が作られていたんだそうです。
細胞は、過剰なPUFAによる膜障害を回避する為にDGAT1/2の作用によって、PUFAをトリアシルグリセロール(TAG)に組み込んで、脂肪滴に貯蔵する事で膜から隔離し、過酸化感受性を低下させています。因みに、脂肪滴を表す言葉として、lipid droplet, lipid body, oil body, adiposome等が使われていますが、英語を母国語とする人にとってはdropletという単語は細胞の中にボテッと置かれた脂肪の塊という印象を与えるらしく…、HISAKOも、モーパッサンの脂肪の塊ではありませんが、学生時代はスライドの中に無為にぼてっと鎮座しているだけの存在としての認識しかありませんでした。その為、bodyという動きを感じさせる言葉の使用を主張する研究者もいるそうです。あ゛~っ、血のソーセージが、無性に食べたくなってしまった…。HISAKOは食べた事が無いですが、日本でも、戦前、栃木県の田舎では「それそれ」と呼ばれる血腸が作られていたんだそうです。
この様に、脂質過酸化は主に細胞膜等のリン脂質二重膜で進行しますが、近年、細胞内の脂肪滴に蓄積したTAG中のPUFAが過酸化され、フェロトーシスに寄与する事が知られるようになりました。
その他の脂溶性分子によるフェロトーシス感受性の影響
脂質代謝物自体が、酸化反応の開始剤又は抑制剤として機能し、フェロトーシス感受性に影響を及ぼす事も知られるようになりました。
■ALOXによる遊離PUFA及びPUFA含有PEの過酸化反応
遊離のPUFA、又はPUFA(特に、アラキドン酸!)を含むホスファチジルエタノールアミンが、リポキシゲナーゼ(ALOX)とPEBP1の協調作用によって酸化されると、各分子に由来する過酸化物質が蓄積し、これを脂質過酸化反応の開始剤としてフェロトーシスが進行します。
■コレステロール合成中間体7-DHCによるフェロトーシス
2024年、Florencio Porto Freitasらは、コレステロール合成中間体7-DHCが、強力な内因性脂質過酸化抑制剤として機能し、フェロトーシスの抑制に寄与すると報告しました。
■peroxyl radical trappingによる抗酸化作用を示す内因性脂質分子:ビタミンA
抗酸化剤の機能機構としては、酸化促進分子への水素原子供与だけでなく、脂質ペルオキシラジカルに直接付加して不活性化するperoxyl radical trappingが知られています。最近、このperoxyl radical trappingによって脂質過酸化を抑制する内因性分子として、ビタミンAがフェロトーシス抑制に重要である事が明らかにされました。
レドックス制御とフェロトーシス感受性
酸化ストレスによる細胞死であるフェロトーシスは、鉄キレートや脂質ラジカル除去により抑制が可能です。レドックス制御がその感受性の重要な決定因子になります。KEAP1-NRF2系、GPX4-グルタチオン系、FSP1-ユビキノン系、PNPO-PLP系は、何れも脂質過酸化を抑え、抗フェロトーシスに寄与します。活性型ビタミンB6であるPLP(ピリドキサール5’リン酸)は、超硫黄分子の産生に必要な補酵素であり、超硫黄分子による脂質過酸化の阻害を介して、抗フェロトーシス作用を発揮します。フェロトーシス制御は、肺線維症等の疾患に対する新たな治療戦略として期待されています。
GPX4とFSP1
現在、フェロトーシスを制御するレドックス経路は、主なものとしてGPX4-グルタチオン系とFSF1‐ユビキノン系の2つと考えられています。何れの経路も、NADPHを還元力として利用しています。NADPHを産生する酵素の多くは、転写因子NRF2により制御されています。
■GPX4‐グルタチオン系
グルタチオンペルオキシターゼ(GPX)は、還元型グルタチオン(GSH)を使って酸化ストレスを消去する酵素で、GPX1、GPX2、GPX3、GPX4が有名です。何れも含セレン蛋白質ですが、特に、GPX4は過酸化脂質を基質にして対応するアルコールに変換する事で、細胞を過酸化物による酸化障害から保護しており、GPX4の抑制により、フェロトーシス感受性が高まります。脂質の過酸化が酸化ストレスによる細胞死の本質的な原因であり、細胞膜の成分として多価不飽和脂肪酸を含むリン脂質の増加が、容易にフェロトーシスを誘導してしまいます。
■FSP1-ユビキノン系
ユビキノンは、ミトコンドリアの電子伝達系の構成成分としてミトコンドリア内膜に存在し、電子の授受を行っています。細胞膜を含むミトコンドリア外の生体膜にも存在しており、抗酸化作用が認められています。その機序としては、FSP1は、NADPHの還元力を利用して細胞膜内のユビキノンを還元し、還元されたユビキノンは、細胞膜を構成するリン脂質の酸化で生じるラジカルを消失させます。
超硫黄分子によるフェロトーシス抑制
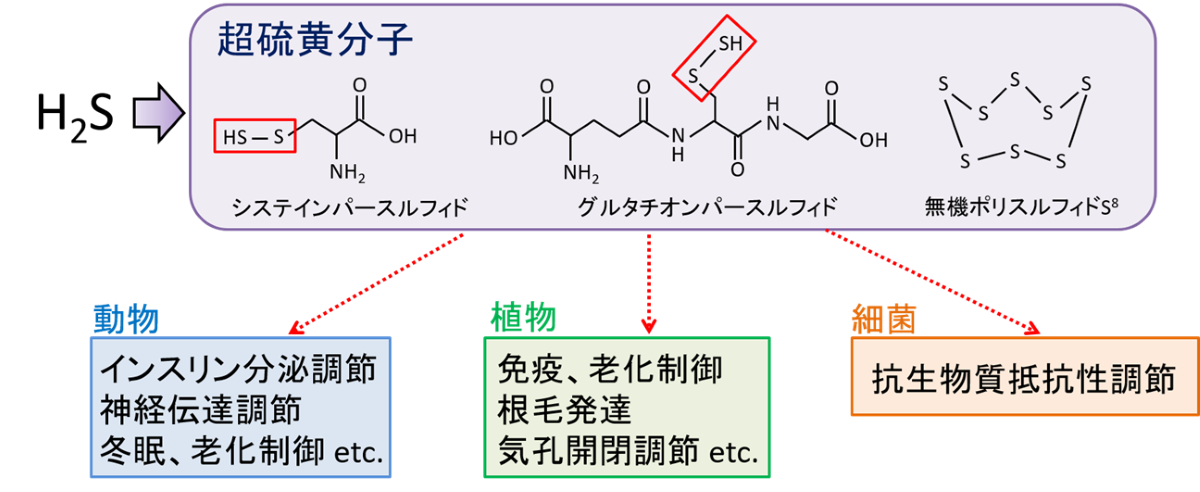 生命活動に於いて、硫黄は不可欠な元素です。特に、生体内の酸化還元反応やエネルギー代謝に於いて、重要な役割を果たしています。近年、複数の硫黄原子が直鎖状に連結した構造を有する超硫黄分子が、生体内で酵素的に産生される事が明らかになりました。超硫黄分子は、生体内で硫黄代謝を通じて、抗酸化作用や細胞保護作用を発揮します。
生命活動に於いて、硫黄は不可欠な元素です。特に、生体内の酸化還元反応やエネルギー代謝に於いて、重要な役割を果たしています。近年、複数の硫黄原子が直鎖状に連結した構造を有する超硫黄分子が、生体内で酵素的に産生される事が明らかになりました。超硫黄分子は、生体内で硫黄代謝を通じて、抗酸化作用や細胞保護作用を発揮します。
超硫黄分子によるフェロトーシス抑制作用は、その抗酸化作用の一環と考えられています。多価不飽和脂肪酸は、酸化されて脂質ラジカルL・になりやすく、それが分子状酸素で酸化されると、脂質ペルオキシラジカルLOO・が生じます。LOO・は、新しいL・を形成すると共に、自身は過酸化脂質LOOHになります。その結果、酸素を消費しながらLOO・とL・の連鎖反応が起こり、過酸化脂質が増加してしまいます。超硫黄分子はラジカル消去能が強く、脂質ラジカルの連鎖反応を断ち切る事により、過酸化脂質の増加を防ぎ、フェロトーシスに対する抵抗性を付与します。
 志賀高原を源とする横湯川の渓谷にある地獄谷温泉は、万座温泉や草津温泉等には硫黄濃度では劣りますが、冬にはサルが温泉に浸かる様子で知られ、不便な道のりにも拘らず、日本国内外から年間約10万人が訪れる一大観光地。サル達は日本国内よりも日本国外で有名で、訪日者に“Snow Monkey”は、「日本で是非とも見たいもの」の上位にランクインしているそうです。因みに、地獄谷野猿公苑では、第1位のサルに敬意を込めて、代々、「龍王」という名前が付けられているんだそうです。
志賀高原を源とする横湯川の渓谷にある地獄谷温泉は、万座温泉や草津温泉等には硫黄濃度では劣りますが、冬にはサルが温泉に浸かる様子で知られ、不便な道のりにも拘らず、日本国内外から年間約10万人が訪れる一大観光地。サル達は日本国内よりも日本国外で有名で、訪日者に“Snow Monkey”は、「日本で是非とも見たいもの」の上位にランクインしているそうです。因みに、地獄谷野猿公苑では、第1位のサルに敬意を込めて、代々、「龍王」という名前が付けられているんだそうです。
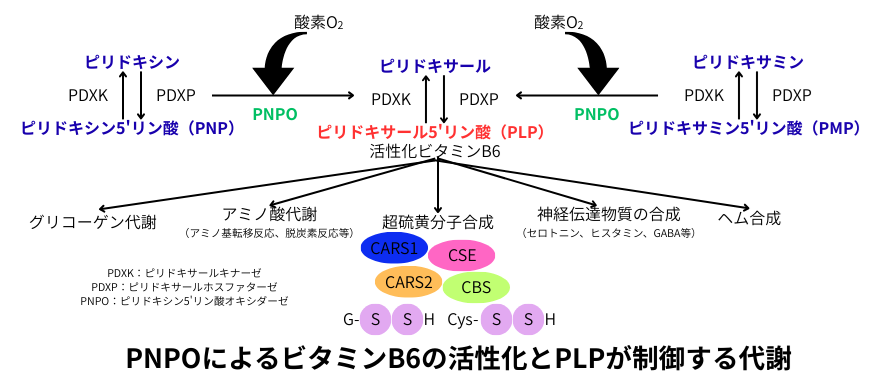
PNPO-PLP制御系
持続する低酸素状態では、ビタミンB6(美容通信2016年4月号)(美容通信2017年9月号)の生体活性化反応が抑制され、活性化ビタミンB6、即ちPLPに依存する代謝反応が抑制されます。
食品に含まれるビタミンB6は、しばしばピリドキシンやピリドキサミンと言った不活性型ですが、これらは体の中で活性型ビタミンB6であるPLPに変換される必要があります。この際に使用される酵素PNPOは、分子状酸素を電子受容体として利用する事で、PNPやPMPに変換します。酸素の供給が滞ると、酸素濃度の低下を鋭敏に感知するとされる酸素センサーでもあるPNPOは、その活性が制限され、PLPは徐々に減少します。
PLPは、アミノ酸代謝、神経伝達物質の合成、グルコーゲン代謝、ヘム合成等の、生体内に於ける重要な補酵素として機能しています。これ等に加えて、CBS、CSE、CARS1、CARS2と言った超硫黄分子の産生酵素は、全てPLP依存性酵素であり、これ等の超硫黄産生酵素は酸素濃度の低下に対して、特に鋭敏に反応します。つまり、慢性的な低酸素状態では、細胞内の超硫黄分子が減少する。裏を返せば、酸素が豊富な環境では、PNPOの活性化によりPLPが増加し、超硫黄分子の産生が促進され、抗酸化作用とフェロトーシス抵抗性を齎す事で、細胞に対して保護的に作用します。
肺線維症とフェロトーシス
特発性肺線維症は、主に肺細胞間質に於ける炎症及び線維化を特徴とする慢性進行性肺疾患で、現在の治療法としては、病態の進行を遅延させる事を目的とした抗線維化薬が主に使われますが、当たり前ではありますが、完全な治療効果を得るには至りません。しかし、近年の報告では、炎症期及び線維化期の病態形成にフェロトーシスが関与しており、また、マウスの実験レベルではありますが、PLPが、ブレオマイシン誘導性肺線維症モデルの炎症期に於ける肺障害を抑制する事が明らかになっています。
フェロトーシス実行の分子メカニズムとその制御戦略
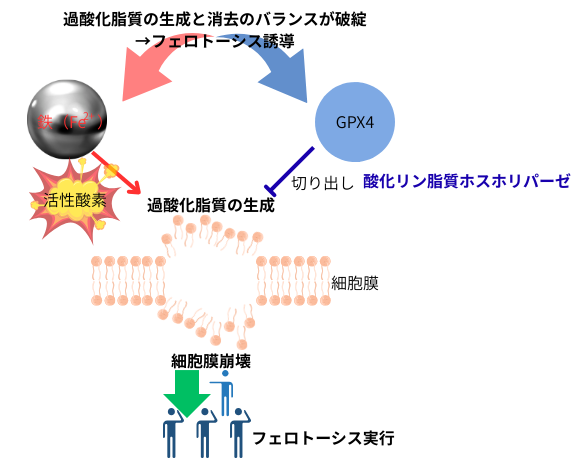 フェロトーシスによる細胞死の特徴は、鉄を介した過酸化脂質の過剰な蓄積による細胞膜の崩壊で、ネクローシス(壊死)の様な偶発的な無秩序な細胞死と誤解を受けがちですが、実際は非常に分子レベルで厳密に制御されたメカニズムにより実行されています。
フェロトーシスによる細胞死の特徴は、鉄を介した過酸化脂質の過剰な蓄積による細胞膜の崩壊で、ネクローシス(壊死)の様な偶発的な無秩序な細胞死と誤解を受けがちですが、実際は非常に分子レベルで厳密に制御されたメカニズムにより実行されています。
細胞内では常に脂質過酸化が生じていますが、前述の通り、過酸化脂質消去酵素であるGPX4がグルタチオンを補因子として、過酸化脂質を還元して無毒化します。これにより、細胞での恒常性が保たれ、生存が維持出来ます。また、脂質過酸化の結果として、膜内に生じた酸化リン脂質等は、酸化リン脂質特異的ホスホリパーゼによって、酸化された脂肪酸部分が切り出されるのと同時に、正常な脂肪酸に再アシル化されて、膜は修復されます。しかし、何らかの要因により、GPV4の様な抗酸化システムが阻害されたり、逆に鉄が増加して細胞内の酸化が亢進すると、過酸化脂質の生成・消去のバランスが崩れ、過酸化脂質が蓄積し、フェロトーシスが誘導されてしまいます。
フェロトーシスは、神経変性疾患、虚血性心疾患、腎・肝障害等の様々な病態の発症・増悪に繋がっています。最近は、抗癌治療戦略としても、注目されています。
フェロトーシスに於ける細胞膜崩壊の分子メカニズム
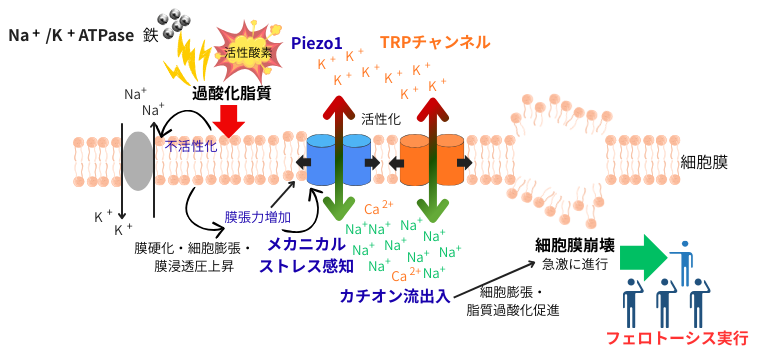
繰り返しになりますが、フェロトーシスは、過酸化脂質の蓄積をトリガーとして誘導されます。脂質過酸化は、膜硬化や細胞の膨張を惹起して、それらによる増加した細胞膜張力がメカニカルストレスとして、機械刺激受容チャンネルであるPiezo1やTRPチャンネルによって感知されます。これ等のチャンネルを介して、カチオン流出入(Na+流入やK+流出)が起こります。これを契機として、急速に細胞膜崩壊が進行=フェロトーシスが実行されます。Na+/K+の細胞内外の濃度勾配を作るトランスポーターNa+/K+-ATPaseも過酸化脂質を不活性化する事から、過酸化脂質の標的と考えられています。
浸透圧は勿論、老化による細胞外マトリックスの硬化、低酸素、細胞密度も、物理的指標に変換されて機械刺激受容体でセンスし、細胞は、酸化ストレスによって生じた脂質過酸化と言う膜への化学的ストレスを、細胞膜の張力増加と言うメカニカルストレスに置き換える事で、感知‐応答システムを迅速に作動させ、フェロトーシスを実行するか否かを即座に判断し、決定します。
■脂質過酸化による細胞膜張力の増加
脂質過酸化が細胞体積や細胞膜張力を増加させる機序としては、脂質過酸化により、細胞膜の透過性が上がって、浸透圧上昇による膨張が引き起こされたのと同時に、一部の膜の流動性・柔軟性低下により膜硬化が進み、結果として細胞の膨張と共に、膜張力を上昇させたと考えられています。
■メカノセンシングを介したフェロトーシスの実行
過酸化脂質の蓄積による細胞の膨張や膜張力の増加と言ったメカニカルストレスが引き金となり、Piezo1の活性化が起こり、カチオン流出入に伴う細胞破裂、即ちフェロトーシスが起こります。Piezo1とは、細胞膜に存在し、細胞膜張力の増加と言ったメカニカルストレスを直接感知して開口する機械刺激受容イオンチャンネルで、細胞内外のイオン濃度勾配に応じてNa+流入やK+流出を引き起こす事で、様々な生理機能を調節しています。Na+/K+の細胞内外の濃度勾配は、細胞膜上のトランスポーターNa+/K+-ATPaseによるATP依存的な能動輸送で形成されますが、脂質過酸化により、このトランスポーターの酵素活性も大きく低下してしまいます。つまり、過酸化脂質の蓄積が、Na+/K+-ATPaseの活性抑制と共に、細胞膜張力増加に伴うPiezo1の開口を生じさせ、両者の相乗効果によるカチオン流出入が、フェロトーシス実行に先行して起こっています。
■フェロトーシス実行に於けるカチオン流出入の重要性
カチオンの流出入は細胞膜崩壊の為に必須の前提であり、フェロトーシス実行に対して促進的に働きます。
■フェロトーシス実行への他のメカノセンサーの関与
TRPファミリーは、メカニカルストレスは勿論、温度、浸透圧、pHと言った物理化学的刺激で開口する非選択的カチオンチャンネルです。TRPチャンネルも、過酸化脂質蓄積に伴う細胞膜張力の変化を感知して開口し、Piezo1と協力的にカチオン流出入を惹起して、フェロトーシス実行を促進します。
老化に於ける鉄代謝とフェロトーシス
個体老化とフェロトーシス
■個体老化に伴う鉄量の増加と抗酸化能力の低下
加齢に伴い、生体内の鉄量が増加し、抗酸化酵素の活性が低下します。フェロトーシスを規定する2因子の何れもが、加齢に伴い、フェロトーシス促進の方向に進み、様々な臓器がフェロトーシスの起こりやすい状態となります。これが、加齢性疾患の発症の一因にもなります。
- 鉄量の増加
加齢に伴う鉄の蓄積は、昆虫から私達人間様に至るまで、広く種を超えて様々な組織で認められています。私達人間では、体内の鉄蓄積量の指標である血清フェリチン量が、若年期から中年期に掛けて増加します。個体レベルでは鉄を積極的に排出する機構が確認されていません。例外として、女子の月経がありますが、生殖期に限られたお話でしかなく、50歳前後の閉経後には血清フェリチン量は急増します。また、女子では、血中エストロゲンとフェリチンの値は逆相関関係にあり、閉経後に様々な疾患が発症します。
加齢に伴う鉄量の増加は、全身性にフェロトーシスが発症しやすい基盤を形成しており、加齢性疾患の発症や進展の主な要因となります。
- 抗酸化力の低下
私達は酸素を利用して生きている以上、活性酸素種reactive oxygen specis:ROS(美容通信2017年10月号)の発生は避ける事が出来ません。しかしこのROSに対する第一防御因子として、superoxide dismutase(SOD)、catalase(CAT)、glutathione peroxidase(GPX)等の抗酸化酵素が知られています。SODは、スーパーオキシドアニオン(・O2-)を、CATは過酸化水素を、GPXは脂質過酸化物及び過酸化水素を除去する酵素ですが、悲しい事に、加齢と共に、これ等の酵素活性は軒並み低下してしまいます。フェロトーシスに於いては、酸化ストレスに対する第一防御因子であるこれ等の酵素の活性低下は、齢性疾患の発症に関与し得る由々しき事態に発展しかねません。
■フェロトーシスが個体老化に及ぼす作用
線虫やマウスの実験では、フェロトーシスが、動脈硬化や腹部大動脈瘤と言った血管老化に伴う疾患を促進する作用がある事が分かっています。
細胞老化とフェロトーシス
■細胞老化
生体に於いて、加齢と共に細胞老化を起こした細胞(老化細胞)が蓄積し、炎症性因子を含む様々な物質を分泌するSASP「細胞老化随伴分泌現象」(美容通信2027年9月号)(美容通信2026年10月号)を介して、神経変性疾患や癌、動脈硬化等の様々な加齢性疾患の発症や進展を促進します。HISAKOの美容通信でも何度か取り上げていますが、最近は、老化細胞を選択的に細胞死に誘導する化合物やSAPSを阻害する化合物(美容通信2027年12月号)の研究が花盛り(⋈◍>◡<◍)。✧♡です。
■老化細胞に於ける鉄代謝とフェロトーシス
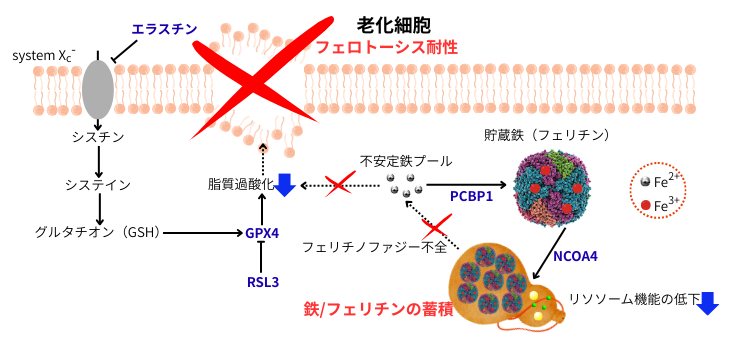 老化細胞では、リソソームの機能が低下している為、フェリチンの分解機構であるフェリチノファジーに不全が生じ、鉄及びフェリチンが細胞内に蓄積するだけでなく、フェリチンに貯蔵された鉄から不安定鉄プールへの鉄の供給が抑制されます。この様な状況では、老化細胞はフェロトーシス誘導剤であるエラスチン(シスチントランスポーターsystem xc–の阻害剤)やRSL3(GPX4阻害剤)の処置下でも、脂質過酸化反応が起きにくく、フェロトーシス耐性を示します。
老化細胞では、リソソームの機能が低下している為、フェリチンの分解機構であるフェリチノファジーに不全が生じ、鉄及びフェリチンが細胞内に蓄積するだけでなく、フェリチンに貯蔵された鉄から不安定鉄プールへの鉄の供給が抑制されます。この様な状況では、老化細胞はフェロトーシス誘導剤であるエラスチン(シスチントランスポーターsystem xc–の阻害剤)やRSL3(GPX4阻害剤)の処置下でも、脂質過酸化反応が起きにくく、フェロトーシス耐性を示します。
■生体内に於ける鉄蓄積と細胞老化
最近、マウスの肺、心臓、腎臓等の組織損傷後の線維症では、血管障害や溶結が引き金となって鉄が蓄積し、細胞老化やSASP、そして線維化が促進される事が示されました。
フェロトーシスと癌
癌の進展3段階
フェロトーシスは、治療抵抗性を示す癌に対する新たな治療法開発の突破口として、近年注目を集めています。癌の進展は、大きく、イニシエーション、プロモーション、プログレッションの3段階に分けられます。イニシエーションでは、偶発的、或いは発癌性物質による遺伝子変異が、細胞増殖や生存、分化等の細胞機能に影響を及ぼす様になります。続くプロモーションの段階では、こうした遺伝子の更なる蓄積により細胞増殖が加速し、より生存に有利な細胞増殖が加速し、細胞クローンの多様性に変化が生じます。その後のプログレッションでは、癌細胞がその増殖に有利な腫瘍微小環境を構築しながら、成長を加速させ、周辺組織への浸潤や血管・リンパ管を通じた転移を引き起こします。癌細胞は、これ等の腫瘍進展の各段階でフェロトーシスへの感受性を動的に変化させ、周囲の環境に適応しながら増殖します。遺伝子変異と環境因子が複雑に作用する癌化の過程に於いては、フェロトーシスに抵抗する細胞内プログラムの確立が、選択的な癌細胞の増殖に寄与する可能性があります。
■癌発生初期(イニシエーション)とフェロトーシス
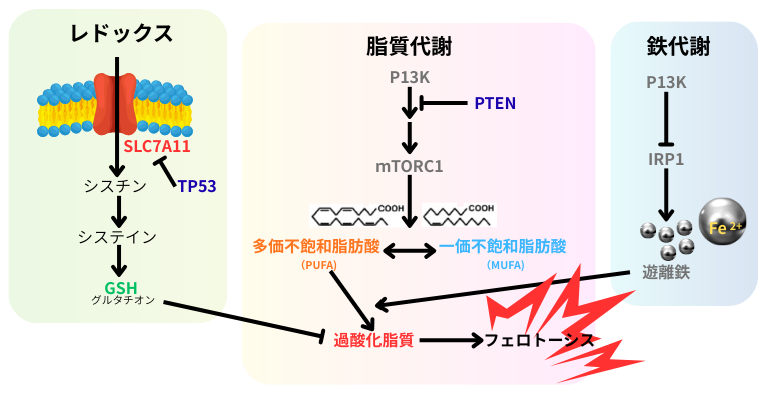 2012年のフェロトーシスの発見以降、イニシエーションで生じる幾つかの遺伝子変異が、細胞のフェロトーシス感受性と関連する事が明らかにされ、正常細胞の癌化に於けるフェロトーシスの役割が注目されています。癌関連遺伝子変異は、細胞内レドックスバランスや脂質代謝、鉄代謝に影響を及ぼし、癌細胞にフェロトーシス抵抗性を付与します。
2012年のフェロトーシスの発見以降、イニシエーションで生じる幾つかの遺伝子変異が、細胞のフェロトーシス感受性と関連する事が明らかにされ、正常細胞の癌化に於けるフェロトーシスの役割が注目されています。癌関連遺伝子変異は、細胞内レドックスバランスや脂質代謝、鉄代謝に影響を及ぼし、癌細胞にフェロトーシス抵抗性を付与します。
癌化の初期段階にフェロトーシスに対する抵抗性を築く事が、癌細胞の成長を可能にするひとつの要因と考えられます。
■癌発生中期(プロモーション)とフェロトーシス
近年のシークエンス技術の発展により、癌関連遺伝子変異を有する異常細胞は、正常組織内にも散在しています。こうした不均一な変異細胞集団から細胞が癌化するプロモーションの過程では、成長因子やホルモン等の発癌促進因子が、変異細胞の異常増殖や細胞の不死化を引き起こし、生存に有利な細胞がクローン性に増殖します。この過程では、フェロトーシスに抵抗する細胞内プログラムを確立しながら、周囲環境に適応し、生存に有利な細胞がクローン性に増殖します。
■プログレッション
- 腫瘍微小環境とフェロトーシス
周囲組織に比べて増殖の優位性を獲得した癌細胞は、腫瘍微小環境を構築し、更に腫瘍を増大させて行きます。腫瘍微小環境は、癌細胞や免疫細胞、血管内皮細胞、線維芽細胞等の多様な細胞種で構成されていますが、これ等の相互作用に於けるフェロトーシスの役割が近年明らかになって来ました。
細胞障害性T細胞は、癌細胞に対してフェロトーシスを誘導して、腫瘍の進展を抑制します。一方、骨髄由来抑制細胞や細胞障害性T細胞のフェロトーシスは、免疫抑制的な腫瘍微小環境を作り出し、腫瘍の進展に寄与します。つまり、癌細胞に於けるフェロトーシス誘導は腫瘍抑制的に働く一方で、免疫系細胞に於けるその誘導は宿主の癌に対する免疫応答を抑制し、腫瘍進展に寄与します。つまり、腫瘍微小環境に於ける単純なフェロトーシスの誘導は、逆に腫瘍の進展を助長する結果になってしまいます。如何に癌細胞選択的なフェロトーシスの誘導を行うかが、創薬開発の課題とされています。
- 転移とフェロトーシス
上皮由来の癌細胞は、上皮間葉転換によって運動能や浸潤能を獲得し、基底膜を超えて遠隔組織に転移します。上皮間葉転換を起こした癌細胞は、様々な治療に抵抗性を示す一方で、フェロトーシスに対する感受性が高い事が知られています。また、転移能とフェロトーシス感受性は多くの癌で相関しており、血管内に侵入した癌細胞は、ACSL4による多価不飽和脂肪酸の増加により、フェロトーシス感受性が高まると同時に、細胞膜の膜流動性が上昇し、細胞の浸潤性が増加する為に、癌細胞の血管外遊出が促進されます。
上皮間葉転換を起こした癌細胞は、血管を通じた遠隔転移に先立ち、リンパ管を通じてより局所的な転移を引き起こします。リンパ液中は、血液中に比べて鉄分が少なく、グルタチオンや一価不飽和脂肪酸の一種であるオレイン酸が多く含まれる為、癌細胞はフェロトーシスから保護され、転移能は高まります。こうした環境は、癌細胞のフェロトーシス抵抗性を強化し、その後の血液を介した転移過程での生存能力を高める要因となります。
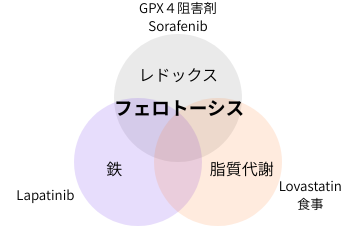 フェロトーシスと治療応用
フェロトーシスと治療応用
 フェロトーシス誘導剤は、従来の癌治療とは異なるメカニズムで癌細胞死を引き起こす為、治療抵抗性を示す癌に対する新たな治療戦略として注目されています。特に、治療抵抗性の癌細胞については、脂質過酸化抑制の為GPX4に強く依存している事が多く、RSL3等のGPX4阻害薬は新たな治療戦略として注目されています。その他、シスチンの取込みを標的としたSorafenib(ネクサバール)や、鉄を標的としたLapatinib(タイケルブ)、脂質代謝を標的としたLovastatin(ロバスタチン)等、フェロトーシスを誘導する3つの側面を標的にした様々な臨床試験が行われています。また、食事によるフェロトーシス誘導も治療戦略の一つであり、高脂肪・低炭水化物のケトジェニックダイエットや、青魚に多く含まれるEPA(美容通信2010年6月号)・DHAと言った多価不飽和脂肪酸摂取による癌細胞へのフェロトーシス誘導が行われています。
フェロトーシス誘導剤は、従来の癌治療とは異なるメカニズムで癌細胞死を引き起こす為、治療抵抗性を示す癌に対する新たな治療戦略として注目されています。特に、治療抵抗性の癌細胞については、脂質過酸化抑制の為GPX4に強く依存している事が多く、RSL3等のGPX4阻害薬は新たな治療戦略として注目されています。その他、シスチンの取込みを標的としたSorafenib(ネクサバール)や、鉄を標的としたLapatinib(タイケルブ)、脂質代謝を標的としたLovastatin(ロバスタチン)等、フェロトーシスを誘導する3つの側面を標的にした様々な臨床試験が行われています。また、食事によるフェロトーシス誘導も治療戦略の一つであり、高脂肪・低炭水化物のケトジェニックダイエットや、青魚に多く含まれるEPA(美容通信2010年6月号)・DHAと言った多価不飽和脂肪酸摂取による癌細胞へのフェロトーシス誘導が行われています。
また、フェロトーシス誘導による免疫療法への相乗効果も注目されています。フェロトーシスによる細胞死は、ダメージ関連分子パターン(damage-associated molecular patterns:DAMPs)(美容通信2024年3月号)(美容通信2027年9月号)を放出する為、主に、樹状細胞を介した適応免疫を効率的に活性化し、免疫チェックポイント阻害剤の治療効果を高めると期待されています。
フェロトーシスと腎組織障害
フェロトーシス
フェロトーシスは、急性腎障害AKI、慢性腎障害CKD(美容通信2026年10月号)(美容通信2027年11月号)を始めとする多岐に亘る腎疾患に於いて、重要な役割を担っています。
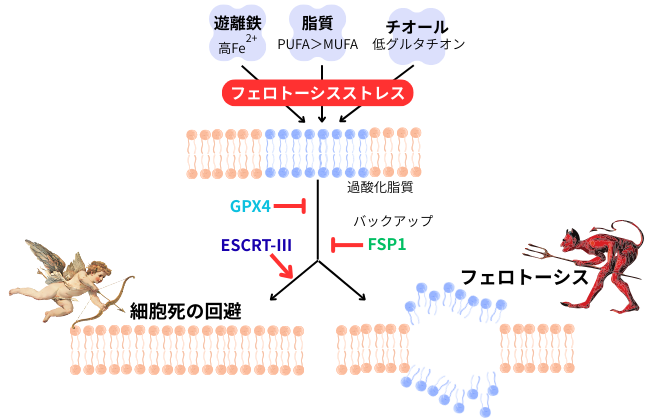 繰り返しになりますが、フェロトーシスは細胞膜のレドックスホメオスタシスの破綻による細胞死ですが、他の細胞死と異なり、ドミノ倒しのように周辺細胞へと広範囲に伝播し、ある意味能動的に組織障害を広げていく独自の性質を有しています。この特徴は、鳥類の四肢発生に於ける筋肉のリモデリングに必須とされ、「ふ~ん」としか言いようがないのですが…興味深い話ではあります。
繰り返しになりますが、フェロトーシスは細胞膜のレドックスホメオスタシスの破綻による細胞死ですが、他の細胞死と異なり、ドミノ倒しのように周辺細胞へと広範囲に伝播し、ある意味能動的に組織障害を広げていく独自の性質を有しています。この特徴は、鳥類の四肢発生に於ける筋肉のリモデリングに必須とされ、「ふ~ん」としか言いようがないのですが…興味深い話ではあります。
更にフェロトーシスが惹起されようとした細胞では、その感受性を抑制する分子群と共に、促進する分子群ACSL4、トランスフェリン受容体の発現をも増強させ、あたかも細胞内で細胞死に向かって綱引きの様相を呈します。実際、主に培養細胞を用いた研究では、GPX4の機能が抑制されて細胞死への道が開いただけでは、必ずしもその細胞が死に至る訳ではなく、細胞死を抑制する二重、三重の抑制メカニズムが働き、それを乗り越えて(?)初めて細胞死に至れる…。
フェロトーシスと腎臓病
腎臓の上皮細胞の約50%を占める近位尿細管細胞は、脂質を主なエネルギー源として、大量のエネルギーを消費しながら、体液の恒常性を維持しています。急性腎障害AKIは、薬物、虚血、感染等により腎機能が急速に失われる病態です。慢性腎臓病CKDは、糖尿病、高血圧等の様々な要因により、腎臓の構造や機能の異常が3ヶ月を超えて持続する病態です。CKDは、日本人成人の約5人に1人(約2000万人)が罹患する国民病で、脳卒中や心筋梗塞等の心血管疾患を引き起こすリスクを高めます。近年の臨床研究により、AKIの患者の多くが腎修復不全を生じ、CKDに移行(美容通信2026年10月号)します。
■フェロトーシスによる腎障害の進展機序
近位尿細管は、フェロトーシスに最も感受性の高い細胞の一つで、常にGPX4により保護されています。腎障害により、GXP4蛋白質の分解が生じ、NADPHレベルの低下も相まって、GPX4による抑制系が機能不全に陥ります。脂質過酸化が促進され、細胞にフェロトーシスストレスが掛かると、一部の細胞は細胞死に至る(フェロトーシス)が、細胞死を逃れた細胞に於いても、転写リプログラミングが生じ、炎症性近位尿細管細胞になります。両者は共に腎臓内の炎症を惹起し、組織修復の抑制、組織線維化を進め、CKDを引き起こします。
関連ページ
関連するHISAKOの美容通信をピックアップしました。
来月号の予告
ウィルス性疣贅治療薬~カンタリジン外用液剤
<ワイキャンス>